
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是
SnI4制备SnI4。下列说法错误的是
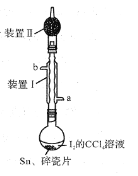
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z原子半径的顺序为Z>X>Y,基态X原子p能级上的电子数是Y原子质子数的3倍,它们可以形成离子化合物![]() ,其中阳离子
,其中阳离子![]() (已知
(已知![]() 水合物的
水合物的![]() 为
为![]() 、
、![]() 为
为![]() )的结构如图所示。下列叙述错误的是
)的结构如图所示。下列叙述错误的是
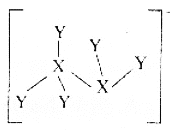
A.![]() 的阴、阳离子均含有18个电子
的阴、阳离子均含有18个电子
B.常温下,![]() 的水溶液呈碱性
的水溶液呈碱性
C.三种元素中Y的电负性最小
D.简单气态氢化物的还原性:X>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为 NA
B. 通常状况下,NA 个CO2分子占有的体积为22.4L
C. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钽是一种过渡金属,钽酸锂(LiTaO3)可用于制作滤波器。一种制备钽酸锂的流程如下:回答下列问题:
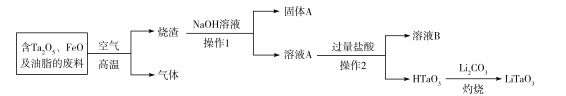
(1)LiTaO3中钽的化合价为___。
(2)同体A呈红色,其主要成分是___(写化学式),常见用途有___(填一种即可)。
(3)操作2的名称是___,用来检验溶液B中阴离子的常用试剂是___。
(4)HTaO3是___(填字母)。
a.难溶的强酸 b.可溶的弱酸 c.可溶的强酸 d.难溶的弱酸
(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为___。
(6)上述废料中含Ta2O5的质量分数为44.2%,杂质不含Ta元素。现有100kg该废料,按上述流程最多可制备___kgLiTaO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
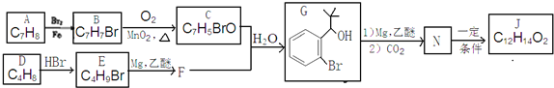
已知:①R-Br![]()
②E的核磁共振氢谱只有一组峰;
③C能发生银镜反应;
④J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)由A生成B的化学方程式为__________,其反应类型为__________;
(2)D的化学名称是__________,由D生成E的化学方程式为__________;
(3)J的结构简式为__________;
(4)G的同分异构体中核磁共振氢谱有4组峰且能与FeCl3溶液发生显色反应的结构简式__________(写出一种即可);
(5)由甲醛和化合物A经下列步骤可得到2—苯基乙醇:A![]() K
K![]() L
L![]()
![]() 。反应条件1为__________;反应条件2所选择的试剂为__________;L的结构简式为__________。
。反应条件1为__________;反应条件2所选择的试剂为__________;L的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn2+催化H2O2分解:2H2O2(aq)===2H2O(l)+O2(g) ΔH1,其反应机理如下:
若反应Ⅱ的晗变为ΔH2,反应Ⅰ、Ⅱ的化学计量数均为最简整数比,则反应Ⅰ的晗变ΔH为( )
A. ΔH1+ΔH2 B. ΔH1-ΔH2 C. 2ΔH1-ΔH2 D. ΔH1-2ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )
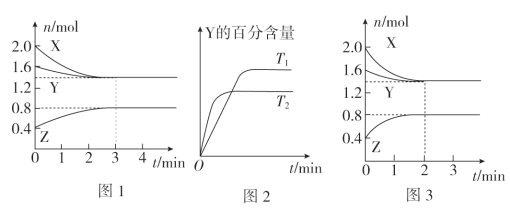
A.容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)+ O2(g)![]() 2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)=_____mol
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是________
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是______
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。

A.加了催化剂 | B.缩小容器体积 |
C.降低温度 | D.增加SO3的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com