
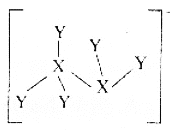
【题目】短周期元素X、Y、Z原子半径的顺序为Z>X>Y,基态X原子p能级上的电子数是Y原子质子数的3倍,它们可以形成离子化合物![]() ,其中阳离子
,其中阳离子![]() (已知
(已知![]() 水合物的
水合物的![]() 为
为![]() 、
、![]() 为
为![]() )的结构如图所示。下列叙述错误的是
)的结构如图所示。下列叙述错误的是
A.![]() 的阴、阳离子均含有18个电子
的阴、阳离子均含有18个电子
B.常温下,![]() 的水溶液呈碱性
的水溶液呈碱性
C.三种元素中Y的电负性最小
D.简单气态氢化物的还原性:X>Z
【答案】B
【解析】
X、Y、Z是短周期元素,基态X原子p能级上的电子数是Y原子质子数的3倍,且原子半径X>Y,根据X2Y5+离子的结构示意图可知,X为N元素,Y为H元素,又X、Y、Z可形成离子化合物X2Y5Z,且原子半径Z>X,则Z为Cl元素,据此分析解答问题。
A.X2Y5Z为N2H5Cl,化合物中阴离子为Cl-,含有18个电子,阳离子为N2H5+,含有的电子总数为7×2+1×5-1=18,A正确;
B.已知N2H4水合物的![]() 为
为![]() 、
、![]() 为
为![]() ,则N2H4的水合物N2H4·H2O为弱碱,因此常温下,N2H5Cl溶液中N2H5+水解显酸性,B错误;
,则N2H4的水合物N2H4·H2O为弱碱,因此常温下,N2H5Cl溶液中N2H5+水解显酸性,B错误;
C.非金属性越强,电负性越大,非金属性H元素最弱,故H的电负性最小,C正确;
D.X、Z的简单氢化物分别为NH3、HCl,元素非金属越强对应阴离子的还原性越弱,由于氧化性Cl>N,则NH3的还原性更强,D正确;
答案选B。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:

(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
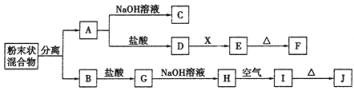
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列说法正确的是
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列说法正确的是
①用A表示的反应速率是0.4mol·L-1·min-1
②在2min末时,反应物B的反应速率是0.3mol·L-1·min-1
③在这2min内用C表示的平均速率为0.2mol·L-1·min-1
④在2min时,B、C、D的浓度比一定为3∶2∶1
⑤若D的起始浓度为0.1mol·L-1,则2 min时D的浓度为0.3mol·L-1
A.①②③B.②③⑤C.④⑤D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生利用下图所列装置进行“铁与水蒸气反应”的实验。(图中夹持及尾气处理装置均已略去)
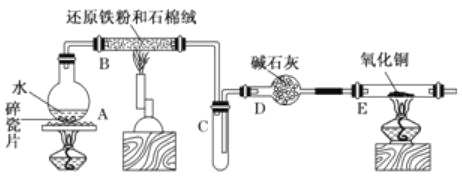
(1)回答下列问题:所用铁粉中若有杂质铝,欲除去不纯铁粉中混有的铝粉可以选用的试剂为____________(填序号)。
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸 D. FeCl3溶液
此步涉及反应的离子方程式为________________________。经除杂后的铁粉进一步干燥后装入反应容器。
(2)反应发生后装置B中发生反应的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中发生可逆反应A(g)+B(g)![]() C(g) △H>0,平衡移动关系如下图所示下列说法正确的是
C(g) △H>0,平衡移动关系如下图所示下列说法正确的是
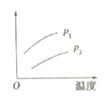
选项 | 压强 | 纵坐标 |
A | p1>p2 | B的转化率 |
B | p1<p2 | C的物质的量浓度 |
C | p1<p2 | 混合气体的平均摩尔质量 |
D | p1>p2 | A的质量分数 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮的碘代反应![]() 的速率方程为
的速率方程为![]() ,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为
,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为![]() 改变反应物浓度时,反应的瞬时速率如表所示。
改变反应物浓度时,反应的瞬时速率如表所示。
|
|
|
0.25 | 0.050 | 1.4 |
0.50 | 0.050 | 2.8 |
1.00 | 0.050 | 5.6 |
0.50 | 0.100 | 2.8 |
下列说法正确的是( )
A.速率方程中的![]() 、
、![]()
B.该反应的速率常数![]()
C.增大![]() 的浓度,反应的瞬时速率加快
的浓度,反应的瞬时速率加快
D.在过量的![]() 存在时,反应掉87.5%的
存在时,反应掉87.5%的![]() 所需的时间是375min
所需的时间是375min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是
SnI4制备SnI4。下列说法错误的是
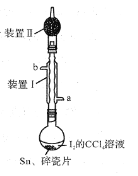
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com