
【题目】I.有机物的结构可用“键线式”简化表示。如:CH3-CH=CH-CH3可简写为![]() 某有机物X的键线式为
某有机物X的键线式为
(1)该有机物X的分子式为____;X与足量的H2在一定条件下反应可得到有机物Y,则Y分子的一氯取代产物有____种。
(2)X属于(填下列选项代码)____。
A.芳香烃 B.环烃 C.不饱和烃 D.炔烃
(3)X的同分异构体Z属于芳香烃,能使溴水褪色,Z的结构简式为____,该芳香烃Z在常温常压下与溴水发生反应,写出生成物的结构简式____。
II.某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。

(1)该物质的结构简式为____。
(2)该物质中所含官能团的名称为____。
(3)写出该物质与CH3CH2OH发生反应的化学方程式____,该反应的类型为____。
【答案】 C8H8 2 BC 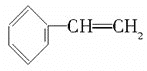
![]() 碳碳双键、羧基
碳碳双键、羧基 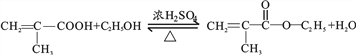 酯化反应(或取代反应)
酯化反应(或取代反应)
【解析】I.(1)该有机物X的分子式为C8H8;X与足量的H2在一定条件下反应可生成环状的饱和烃Z,![]() 结构对称,含-CH2、-CH上方2种位置的H,则Z的一氯代物有2种;
结构对称,含-CH2、-CH上方2种位置的H,则Z的一氯代物有2种;
(2)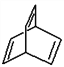 不含有环,但不是苯环,含有碳碳双键,具有不饱和烃的性质,故答案为BC;(3)有机物Y是X的同分异构体,且属于芳香烃,则含苯环,还含C=C,则Y的结构简式为
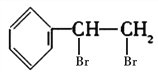
不含有环,但不是苯环,含有碳碳双键,具有不饱和烃的性质,故答案为BC;(3)有机物Y是X的同分异构体,且属于芳香烃,则含苯环,还含C=C,则Y的结构简式为![]() ;与溴水发生反应,生成物的结构简式为
;与溴水发生反应,生成物的结构简式为![]() ;
;
II.由分子模型可知该有机物的结构简式为![]() ;
;
(2)由(1)中结构简式可知该有机物中含有碳碳双键、羧基官能团;
(3)该物质与CH3CH2OH发生反应的化学方程式为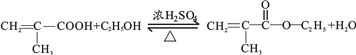 ,该反应的类型为酯化反应(或取代反应)。
,该反应的类型为酯化反应(或取代反应)。


科目:高中化学 来源: 题型:
【题目】向氢氧化铁溶胶中逐滴加入一种液体,首先使溶胶发生凝聚而沉淀,继续加入使沉淀消失,这种液体是( )
A. 0.5mol/L氢氧化钠溶液 B. 0.5mol/L盐酸
C. 0.5mol/L氯化钾溶液 D. 蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近《科学》杂志评出十大科技突破,其中“火星上‘找’到水的影子”排名笫一。下列关于水的说法中正确的是
A. 水的电离是放热的过程 B. 加入电解质一定会破坏水的电离平衡
C. 水的电离和电解都需要电 D. 水、乙酸和硫酸钡均属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质(括号内是杂质)所用试剂不正确的是( )
A. NaHCO3溶液[Na2CO3]:用CO2气体 B. Mg粉[Al]:用NaOH溶液
C. CO2气体[H2O]:用碱石灰 D. HNO3溶液[HCl]:用AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一化学平衡状态体系中,发生下列量的变化,其中一定会使平衡发生移动的是( )
A. 反应物的转化率 B. 反应物的浓度
C. 正、逆反应速率 D. 体系的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)海水淡化的方法有_______(填一种)。
(2)写出氯化钠的形成过程:_____________。
(3)从海水中提取镁的流程如下图所示:
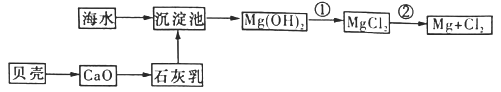
反应②的化学方程式为_______________。
从海水中提取溴的主要步骤是向浓缩的海水中通人氯气,将溴离子氧化,该反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10mL单质气体X2和20mL单质气体Y2完全反应后,恰好生成20mL气体Z,若上述三种气体的体积都是在同温、同压下测定的,则气体Z的分子式是( )
A. XY2 B. X2Y C. XY D. X2Y4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲烷和氧气按9:1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802kJ/lmol
CH3OH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g) △H=__________
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。其工作原理如下图所示。a是电池的____极(填“正”或“负”) ,b极的电极反应式为__________。

(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90kJ/mol
CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。

④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,则通入a气体的电极反应式为_____________,通入b气体的电极反应式为 _____________________。(质子交换膜只允许H+通过)
(2)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在 _________左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 _______________________________。
(3)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下11.2 L CH4可处理22.4 L NOx,则x值为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com