
【题目】向氢氧化铁溶胶中逐滴加入一种液体,首先使溶胶发生凝聚而沉淀,继续加入使沉淀消失,这种液体是( )
A. 0.5mol/L氢氧化钠溶液 B. 0.5mol/L盐酸
C. 0.5mol/L氯化钾溶液 D. 蒸馏水
科目:高中化学 来源: 题型:
【题目】同一物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是()
A. Cl2+H2O=HCl+HClO B. NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
C. 5NH4NO3![]() 2HNO3+ 4N2↑ + 9H2O D. SO2+2H2S=2H2O+3S
2HNO3+ 4N2↑ + 9H2O D. SO2+2H2S=2H2O+3S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢分子中含有过氧键(﹣O﹣O﹣).有机化合物A的相对分子质量为120.经分析,其中氧的质量分数为0.5334,其余为碳和氢,则A分子中过氧键数最多为( )
A.1
B.2
C.3
D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物H是药物常山酮的合成中间体,合成H的流程图如下:
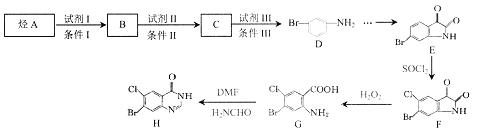
已知:① 苯环上原有取代基对新导入苯环上的取代基位置有一定影响,其规律如下:
-OH、-CH3、-Br等取代基使新导入的取代基主要进入原取代基邻位和对位;
-NO2、-SO3H、-CHO等取代基使新导入的取代基主要进入原取代基间位。
②![]() (-NH2易被氧化)
(-NH2易被氧化)
③ 甲苯可被酸性高锰酸钾氧化为苯甲酸
回答下列问题:
(1)D中的官能团名称为_________。
(2)E→F的反应类型为__________。
(3)B→C的化学反应方程式为___________。
(4)G在一定条件下能发生缩聚反应,该反应方程式为__________。
(5)W与B是同系物,W与B的最大质荷比相差14,同时满足下列条件的W的同分异构体有_______种。
① 能与NaOH溶液反应 ② 苯环上有两个取代基 ③ 遇氯化铁溶液不显色
其中核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:2的所有物质的结构简式是______。
(6)写出以甲苯为原料合成![]() 的流程图(无机试剂任用)_______
的流程图(无机试剂任用)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(1)乙醇分子中官能团的名称是_______。
乙酸中的官能团的结构简式 ________。
(2)试管a中加入几块碎瓷片的目的是____________。
(3)试管a中发生反应的化学方程式为_______________________,反应类型是__________。
(4)反应开始前,试管b中盛放的溶液是____________。
(5)可用____________的方法把制得的乙酸乙酯分离出来。
(6)浓硫酸的作用 _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,在某含有Fe3+和Cu2+的溶液中,c(Fe3+)为4.0×10-8mol·L-1现向该溶液中滴加氨水,当开始出现氢氧化铁沉淀时,溶液的pH及溶液中允许的最大c(Cu2+)为
A. 10 2.2 mol·L-1 B. 4 2.2×10-1 mol·L-1
C. 4 2.2 mol·L-1 D. 10 2.2×10-1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国的锰矿石和锌矿石产地在云南、广东、青海等。软锰矿是一种常见的锰矿石,其主要成分是MnO2,含少量Al2O3和SiO2。闪锌矿主要成分是ZnS,含少量FeS、CuS、CdS等杂质,晶体属于六方晶系。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下。

已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中MnO2、CuS与硫酸共热时有淡黄色物质析出,请写出该反应的化学方程
式___________________。
(2)步骤②加入适量金属锌是为了回收金属,回收金属的主要成分是_________________。
(3)步骤③中MnO2的作用是________________,另外一种物质X可以是__________。
A.ZnO B.MgO C.Cu2(OH)2CO3 D.MnCO3
(4)锂离子电池的正极材料有多种,其中MnO2与Li构成LiMnO2是一种常见的正极材料。电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式_____________________。
已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,
向NaCN溶液中通入少量的H2S气体,反应的离子方程式为_______________________。
在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1 Mn2+废水
中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有机物的结构可用“键线式”简化表示。如:CH3-CH=CH-CH3可简写为![]() 某有机物X的键线式为
某有机物X的键线式为
(1)该有机物X的分子式为____;X与足量的H2在一定条件下反应可得到有机物Y,则Y分子的一氯取代产物有____种。
(2)X属于(填下列选项代码)____。
A.芳香烃 B.环烃 C.不饱和烃 D.炔烃
(3)X的同分异构体Z属于芳香烃,能使溴水褪色,Z的结构简式为____,该芳香烃Z在常温常压下与溴水发生反应,写出生成物的结构简式____。
II.某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。

(1)该物质的结构简式为____。
(2)该物质中所含官能团的名称为____。
(3)写出该物质与CH3CH2OH发生反应的化学方程式____,该反应的类型为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com