
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.通入CO后,正反应速率逐渐增大
B.升高温度,H2S浓度增加,表明该反应是吸热反应
C.CO的平衡转化率为80%
D.反应前H2S物质的量为7mol
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了_____的作用力;二氧化硅熔化,粒子间克服了_____的作用力;碘的升华,粒子间克服了_____的作用力。三种晶体的熔点由高到低的顺序是_____。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为_____ (填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,五种物质的熔点由高到低的顺序是_____。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:A_____;B_____;C_____;D_____。
(5)如图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A_____;B_____;C_____;D_____。
A.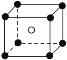 B.
B.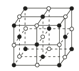 C.
C.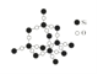 D.
D.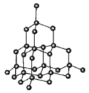
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖与浓硫酸反应的实验改进装置如图所示,下列说法错误的是
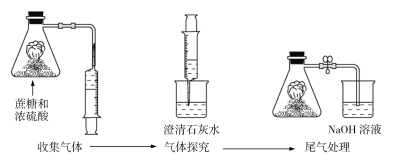
A.改进装置后,有毒气体被碱液吸收,实现了绿色环保
B.浓硫酸在实验过程中体现了脱水性和强氧化性
C.产生的气体能使澄清石灰水变浑浊,说明产生了CO2
D.该反应比较剧烈、危险,实验各物质的用量应按要求规范操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应方程式中不正确的是
A.铁在氯气中燃烧的反应:2Fe+3Cl2![]() 2FeCl3
2FeCl3
B.氨水与稀硫酸的反应:NH3·H2O+H+=H2O+![]()
C.氯气和氢氧化钠溶液的反应:Cl2+2OH-=Cl-+ClO-+H2O
D.铜和稀硝酸的反应:Cu+2H++NO2=Cu2++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
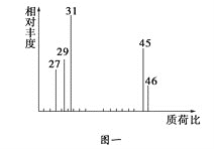

(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
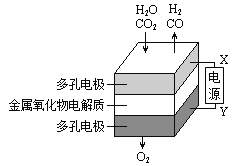
A.阴、阳两极生成的气体的物质的量之比是1︰2
B.X是电源的负极
C.阴极的反应式是:H2O+2e-=H2+O2- CO2+2e-=CO+O2-
D.总反应可表示为:H2O+CO2![]() H2+CO+O2
H2+CO+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___。
(2)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,维持其他条件不变,若打开K,一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响)。
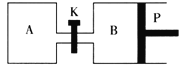
Ⅱ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)![]() CH3OH(g)
CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.27 | 0.012 |
(1)300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,判断反应___(填“正向”或“逆向”)进行。
(2)要提高CO的转化率,可以采取的措施是___(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理及对应的离子方程式均正确的是( )
A.室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++H2ONH3H2O+H+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH﹣═2AlO2﹣+H2↑
C.Na2CO3溶液呈碱性的原因:![]()
D.用酸性高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在实验室研究Al与CuCl2溶液的反应.
实验操作 | 实验现象 |
|
|
(1)现象![]() 中的红色物质是 ______ .
中的红色物质是 ______ .
(2)经检验现象![]() 中的无色气体为氢气.
中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因 ______.
②氢气从红色物质表面逸出的原因是 ______ .
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液![]()
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是 ______.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因 ______.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有 ______性.
②取Cu粉与1mol/LCuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com