
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述正确的是

A. 溶液中的K+移向b电极
B. a极的电极反应式为:2H++2e—= H2↑
C. b极为负极,该电极上发生氧化反应
D. 电子由a极经电解质溶液移向b极
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
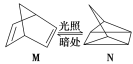 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。

反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是_______________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式_________________________________。
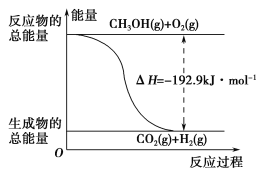
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物的总能量
C.根据②推知反应:CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②的能量变化如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物w用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下:

已知![]()
请回答下列问题
(1)F的名称是__________⑤的反应类型是__________。
(2)E中的含氧官能团的名称为__________,W的结构简式为__________。
(3)反应②的化学方程式是__________。
(4)D自身还能发生聚合反应,其聚合产物的结构简式为__________。
(5)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(其他试剂任选) __________。
示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形式,被广泛应用于电子工业。
(1)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有__________________。
a.KClO3 b. KCl c. MnO2 d. Mg
(2)半导体材料氮化镓由Ga与NH3在一定条件下发生置换反应生成。该过程每生成1molGaN(s)放出热量15.4kJ。镓在周期表中的序号_____________,写出该反应的热化学方程式_________________。
(3)工业上用电解法精炼镓。具体原理如图所示,已知:金属的活动性Zn>Ga>Fe>Cu

①电解精炼镓一段时间后形成的阳极泥主要有______________
②已知精炼时阴极反应:GaO2-+3e-+2H2O=Ga+4OH- 。阳极的电极反应方程式:___________________________________;
Ⅱ.用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

(4)步骤I温度不能过高。因为:_______________________________。
(5)步骤II中发生反应4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,生成的硝酸又将废铁皮中的铁转化为Fe(NO3)2。
写出后者反应的离子方程式______________________________________。
(6)上述生产流程中,能体现“绿色化学”思想的是______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com