
【题目】(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。

反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是_______________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式_________________________________。
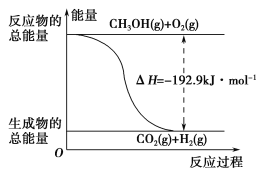
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物的总能量
C.根据②推知反应:CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②的能量变化如图所示
【答案】(1)①吸热 ②相同 一个化学反应的反应热仅与反应始态和终态有关,而与反应的途径无关 ③CH3OH(g)![]() HCHO(g)+H2(g) ΔH=+(E2-E1)kJ·mol-1(2)C
HCHO(g)+H2(g) ΔH=+(E2-E1)kJ·mol-1(2)C
【解析】
(1)①E1<E2,甲醇催化脱氢转化为甲醛的反应是吸热反应。②反应热与反应的始态和终态有关,与反应的途径无关,故反应热相同。
(2)采用反应①将CH3OH转变成H2时,反应吸热,采用反应②将CH3OH转变成H2时,反应放热,A错误;反应物的总能量小于生成物的总能量时,反应吸热,B错误;液态甲醇转变成气态甲醇时,要吸收热量,液态甲醇参与反应时,放出的热量比气态甲醇的少,ΔH变大,C正确;反应②放热,1 mol CH3OH(g)和![]() mol O2(g)的总能量大于1 mol CO2(g)和2 mol H2(g)的总能量,与图示不符,D错误。
mol O2(g)的总能量大于1 mol CO2(g)和2 mol H2(g)的总能量,与图示不符,D错误。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体,取X和Y按物质的量之比1∶1混合,放入某密闭容器中发生反应X+2Y![]() 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
A. 33% B. 40% C. 50% D. 65%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,化学反应的反应热前者小于后者的一组是( )
① CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2;② 2H2(g)+O2(g)═2H2O(l)△H1;H2(g)+![]() O2(g)═H2O(l)△H2;③S(g)+O2(g)=SO2(g) △H1 ;S(s)+O2(g)=SO2(g) △H2 ;④ CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2.
O2(g)═H2O(l)△H2;③S(g)+O2(g)=SO2(g) △H1 ;S(s)+O2(g)=SO2(g) △H2 ;④ CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2.
A. ②③④ B. ②④ C. ①②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1molH—H键、Cl—Cl键、H—Cl键需要吸收的能量分别为436kJ、243kJ、431kJ,则由Cl2和H2生成1molHCl时的反应热为
A. 吸热91.5kJB. 放热91.5kJ
C. 吸热183kJD. 放热183kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述正确的是

A. 溶液中的K+移向b电极
B. a极的电极反应式为:2H++2e—= H2↑
C. b极为负极,该电极上发生氧化反应
D. 电子由a极经电解质溶液移向b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A. NaHCO3=Na++H++ CO32- B. H2SO3![]() 2H++SO32-
2H++SO32-
C. Ba(OH)2=Ba2+ + 2OH- D. AgCl ![]() Ag++Cl-
Ag++Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离了键,又含有共价键的物质是_____,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程:________________。
(3)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用产生NH3。请写出NH3的电子式是____________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是( )

A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也要互换。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42- ===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
【答案】D
【解析】A. 氯化铁溶液中的铁离子具有氧化性,能够氧化碘离子,与碘化钾溶液反应的离子方程式为2Fe3++2I-===2Fe2++I2,故A错误;B. 硫酸溶液与氢氧化钡溶液反应生成硫酸钡沉淀和水,离子方程式为Ba2++SO![]() +2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH
+2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH![]() ,故D正确;故选D。
,故D正确;故选D。
【题型】单选题
【结束】
12
【题目】一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),能说明该反应达到化学平衡状态的是( )
2NH3(g),能说明该反应达到化学平衡状态的是( )
A. N2、H2、NH3的浓度相等 B. N2、H2、NH3的浓度不再变化
C. N2、H2、NH3在密闭容器中共存 D. 反应停止,正、逆反应速率都等于零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com