
【题目】下列各组变化中,化学反应的反应热前者小于后者的一组是( )
① CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2;② 2H2(g)+O2(g)═2H2O(l)△H1;H2(g)+![]() O2(g)═H2O(l)△H2;③S(g)+O2(g)=SO2(g) △H1 ;S(s)+O2(g)=SO2(g) △H2 ;④ CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2.
O2(g)═H2O(l)△H2;③S(g)+O2(g)=SO2(g) △H1 ;S(s)+O2(g)=SO2(g) △H2 ;④ CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2.
A. ②③④ B. ②④ C. ①②③ D. ③④
【答案】C
【解析】
①CH4(g)与O2(g)的反应为放热反应,ΔH1、ΔH2都小于0,由于H2O(l)转变为H2O(g)吸收能量,则ΔH1<ΔH2;
②H2(g)与O2(g)的反应为放热反应,ΔH1、ΔH2都小于0,前者各物质的化学计量数是后者的两倍,则ΔH1=2ΔH2,ΔH1<ΔH2;
③两者都为放热反应,ΔH1、ΔH2都小于0,由于S(g)转变为S(s)放出能量,则ΔH1<ΔH2;
④反应CaCO3(s)=CaO(s)+CO2(g)为吸热反应,ΔH1>0,反应CaO(s)+H2O(l)=Ca(OH)2(s)为放热反应,ΔH2<0,则ΔH1>ΔH2;
反应热前者小于后者的有①②③,答案选C。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4 L CCl4中含CCl4分子数为NA
B. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
C. 0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D. 3.9 g Na2O2 晶体中含有的离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. pH=7的溶液:K+、Na+、Cl-、Fe3+
B. 能使酚酞显红色的溶液:Na+、Mg2+、HCO3-、SO42-
C. c(H+)/c(OH-)=1012的溶液:K+、Fe3+、Cl-、SO42-
D. 水电离出的c(H+)=10-13 mol·L-1的溶液:Ca2+、NH4+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
I.利用下列装置制备NaNO2
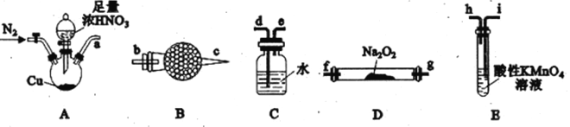
已知:①2NO+Na2O2=2NaNO2;②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。请回答下列问题:
(1)利用上图中的装置制备NaNO2,其连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)实验开始时,先通一段时间N2的目的是__________。
(3)装置B中盛放试剂的名称为__________,装置C的作用是__________。
(4)装置E中发生反应的离子方程式为____________________。
Ⅱ.测定上述实验所制备的NaNO2样品(含NaNO3杂质)的纯度。称量D中所得样品ag溶解后配制成250mL溶液取25.00mL于锥形瓶中,用bmoL-1酸性高锰酸钾溶液滴定到终点。重复上述滴定操作两次,测得数据如下表:
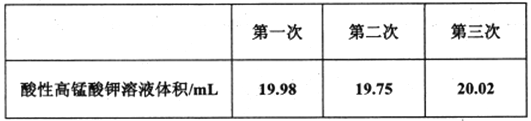
(5)滴定终点的实验现象为_________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是__________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2的质量分数为__________(用含a、b的关系式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。

反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是_______________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式_________________________________。
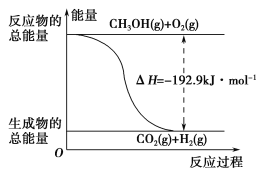
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物的总能量
C.根据②推知反应:CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②的能量变化如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水反应生成一种氯化物和两种氮化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

①制备NO发生装置可以选用___________________(填写字母代号),请写出发生反应的离子方程式:___________________。
②欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ __________________(按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:


①实验室也可用X装置制备NO,X装置的优点为________________________________。
②检验装置气密性并装入药品,打开K2,然后再打开 ____________,通入一段时间气体,其目的为___________________________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中NOCl可能发生反应的化学方程式为________________________。
④若尾气处理装置连接上图烧杯中导管d,则烧杯中可加入 __________溶液。
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(NOC1)的质量分数为________(用代数式表示)。
[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com