
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
I.利用下列装置制备NaNO2
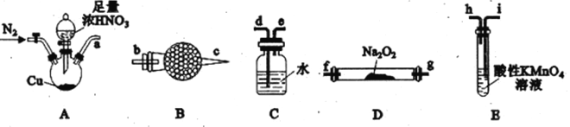
已知:①2NO+Na2O2=2NaNO2;②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。请回答下列问题:
(1)利用上图中的装置制备NaNO2,其连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)实验开始时,先通一段时间N2的目的是__________。
(3)装置B中盛放试剂的名称为__________,装置C的作用是__________。
(4)装置E中发生反应的离子方程式为____________________。
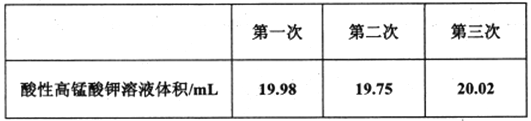
Ⅱ.测定上述实验所制备的NaNO2样品(含NaNO3杂质)的纯度。称量D中所得样品ag溶解后配制成250mL溶液取25.00mL于锥形瓶中,用bmoL-1酸性高锰酸钾溶液滴定到终点。重复上述滴定操作两次,测得数据如下表:
(5)滴定终点的实验现象为_________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是__________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2的质量分数为__________(用含a、b的关系式表示)。
【答案】d→e→b→c→f(或g)→g(或f)→i 排除装置中的空气,防止NO被氧化为NO2 碱石灰或无水氯化钙 将NO2转化为NO 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O 溶液由无色变为紫色(或紫红色),且半分钟不褪色。 c 34.5b/a×100%
【解析】
(1)A装置发生铜与浓硝酸的反应生成NO2,通到C装置中,NO2与水反应生成NO,然后进入B装置进行干燥,干燥完进入D装置和Na2O2反应,最后进入E装置进行尾气处理。
(2)实验开始时,先通一段时间N2的目的是:排除装置中的空气,防止NO被氧化为NO2。
(3)装置B是干燥NO。
(4)装置E中发生NO和酸性KMnO4溶液的反应,NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
(5)NaNO2与酸性高锰酸钾溶液的离子反应为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2+ +3H2O。
(6)酸性高锰酸钾溶液应放在酸式滴定管中,NaNO2样品溶液放在锥形瓶中,第二次实验数据偏小,即V(标)偏小。
(7)第二次实验数据误差较大,故舍去,酸性高锰酸钾溶液的平均体积为:(19.98mL+20.02mL)/2=20mL,根据方程式:5NO2-+2MnO4-+6H+=5NO3-+2Mn2+ +3H2O来解答。
(1)A装置发生铜与浓硝酸的反应生成NO2,通到C装置中,NO2与水反应生成NO,然后进入B装置进行干燥,干燥完进入D装置和Na2O2反应,最后进入E装置进行尾气处理,所以连接顺序为a→d→e→b→c→f(或g)→g(或f)→i,故答案为:d→e→b→c→f(或g)→g(或f)→i。
(2)实验开始时,先通一段时间N2的目的是:排除装置中的空气,防止NO被氧化为NO2,故答案为:排除装置中的空气,防止NO被氧化为NO2。
(3)装置B是干燥NO,应盛放试剂的名称为碱石灰或无水氯化钙,装置C中NO2和水反应生成硝酸和NO,故答案为:碱石灰或无水氯化钙;将NO2转化为NO。
(4)装置E中发生NO和酸性KMnO4溶液的反应,NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+,反应的离子方程式为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O。
(5)NaNO2与酸性高锰酸钾溶液的离子反应为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2+ +3H2O,滴定终点的实验现象为:溶液由无色变为紫色(或紫红色),且半分钟不褪色,故答案为:溶液由无色变为紫色(或紫红色),且半分钟不褪色。
(6)酸性高锰酸钾溶液应放在酸式滴定管中,NaNO2样品溶液放在锥形瓶中,第二次实验数据(酸性高锰酸钾溶液体积)偏小.
a. 滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外,酸性高锰酸钾溶液体积偏大,故a不可能;
b. 加入样品溶液前的锥形瓶是否干燥对实验没有影响,故b不可能;
c. 滴定前仰视读数,滴定后俯视读数,读数出现错误,可以导致酸性高锰酸钾溶液体积V(标)偏小,故c可能。
故选c。
(7)第二次实验数据误差较大,故舍去,酸性高锰酸钾溶液的平均体积为:(19.98mL+20.02mL)/2=20mL,根据方程式:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2+ +3H2O,
5mol 2mol
x 20 mL×10-3×bmoL/L
解得x=0.05bmol,原样品中NaNO2的物质的量为0.5bmol,所以NaNO2的质量分数为(0.5bmol×69g/mol/ag)×100%=34.5b/a×100%,故答案为:34.5b/a×100%。


科目:高中化学 来源: 题型:
【题目】可逆反应N2(g)+3H2(g) ![]() 2NH3(g),△H=-Q kJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2kJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是
2NH3(g),△H=-Q kJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2kJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是
A. 达平衡时,两容器中反应物的转化率不同,甲中N2和H2为80%,乙中NH3为20%
B. 甲中NH3的体积分数与乙相等
C. 达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动
D. 乙中的热化学反应方程式为2NH3(g) ![]() N2(g)+3H2(g);△H=+Q2kJ/mol
N2(g)+3H2(g);△H=+Q2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原HNO3的物质的量之比为2∶1时,还原产物可能是
A.N2OB.NO
C.NO2D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 | |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍 | A的相对分子质量为________ | |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g 和13.2 g | A的分子式为__________ | |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) | 用结构简式表示A中含有的官能团:________、________ | |
(4)A的1H核磁共振谱如图: | A中含有______种氢原子 | |
(5)综上所述,A的结构简式为__________其中手性碳原子______个 | ||
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,化学反应的反应热前者小于后者的一组是( )
① CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2;② 2H2(g)+O2(g)═2H2O(l)△H1;H2(g)+![]() O2(g)═H2O(l)△H2;③S(g)+O2(g)=SO2(g) △H1 ;S(s)+O2(g)=SO2(g) △H2 ;④ CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2.
O2(g)═H2O(l)△H2;③S(g)+O2(g)=SO2(g) △H1 ;S(s)+O2(g)=SO2(g) △H2 ;④ CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2.
A. ②③④ B. ②④ C. ①②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同碳原子数的烷烃、烯烃、炔烃,在空气中完全燃烧生成二氧化碳和水,所需空气量的比较中正确的是 ( )
A.烷烃最少B.烯烃最少
C.炔烃最少D.三者一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1molH—H键、Cl—Cl键、H—Cl键需要吸收的能量分别为436kJ、243kJ、431kJ,则由Cl2和H2生成1molHCl时的反应热为
A. 吸热91.5kJB. 放热91.5kJ
C. 吸热183kJD. 放热183kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A. NaHCO3=Na++H++ CO32- B. H2SO3![]() 2H++SO32-
2H++SO32-
C. Ba(OH)2=Ba2+ + 2OH- D. AgCl ![]() Ag++Cl-
Ag++Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的分子式为C4H10O,M能与金属钠反应产生氢气,则M与乙酸发生酯化反应生成的酯共有(不考虑立体异构)
A.3种B.4种
C.5种D.6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com