
【题目】可逆反应N2(g)+3H2(g) ![]() 2NH3(g),△H=-Q kJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2kJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是
2NH3(g),△H=-Q kJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2kJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是
A. 达平衡时,两容器中反应物的转化率不同,甲中N2和H2为80%,乙中NH3为20%
B. 甲中NH3的体积分数与乙相等
C. 达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动
D. 乙中的热化学反应方程式为2NH3(g) ![]() N2(g)+3H2(g);△H=+Q2kJ/mol
N2(g)+3H2(g);△H=+Q2kJ/mol
【答案】D
【解析】
A、由于1molN2和3molH2完全反应可以生成2molNH3,所以甲乙两个体系的平衡状态是一样的,即平衡时,三种气体的浓度完全相同。对于同一可逆反应,相同条件下,正反应的反应热与逆反应的反应热,数值相等,符号相反。假设N2和H2完全反应时放热Q,则NH3完全分解时吸热也是Q。假设甲容器中的参加反应的氮气的物质的量为xmol,所以:
对于甲容器:N2(g)+3H2(g)2NH3(g)△H=-QkJ/mol
起始(mol): 1 3 0
变化(mol): x 3x 2x
平衡(mol): 1-x 3-3x 2x
所以Q1=xQkJ,乙容器反应混合物各组分的物质的量也是为N2(1-x )mol、H2(3-3x )mol、NH32xmol,所以分解的NH3的物质的量为(2-2x)mol,对于乙容器:2NH3(g)N2(g)+3H2(g)△H=+QkJ/mol,故吸收的热量Q2=![]() ×QkJ=(1-x)QkJ,所以4(1-x)Q=xQ,解得x=0.8,所以N2的转化率为
×QkJ=(1-x)QkJ,所以4(1-x)Q=xQ,解得x=0.8,所以N2的转化率为![]() ×100%=80%,NH3的转化率为
×100%=80%,NH3的转化率为![]() ×100%=
×100%=![]() ×100% =20%,故A正确;B、甲乙容器中达到的平衡是相同平衡,所以氨气的体积分数相同,故B正确;C、依据A分析计算得到平衡物质的量N2为0.2mol,H2为0.6mol,NH3为1.6mol,再向乙中加入0.2mol N2(g)、0.6mol H2(g)和1.6mol NH3(g),相当于增大压强,平衡正向进行,故C正确;D、该反应是可逆反应,乙中反应的热化学方程式为2NH3(g)N2(g)+3H2(g)△H>+Q2kJ/mol,故D错误;故选D。
×100% =20%,故A正确;B、甲乙容器中达到的平衡是相同平衡,所以氨气的体积分数相同,故B正确;C、依据A分析计算得到平衡物质的量N2为0.2mol,H2为0.6mol,NH3为1.6mol,再向乙中加入0.2mol N2(g)、0.6mol H2(g)和1.6mol NH3(g),相当于增大压强,平衡正向进行,故C正确;D、该反应是可逆反应,乙中反应的热化学方程式为2NH3(g)N2(g)+3H2(g)△H>+Q2kJ/mol,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(![]() )中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 重水、超重水都是水的同位素
B. 正丁烷和异丁烷互为同分异构体
C. 金刚石、石墨和富勒烯均为碳的同素异形体,均属于原子晶体
D. 14C是指原子核内含有14个质子的碳的一种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是( )
A.分子发生碰撞就一定发生反应
B.发生有效碰撞的分子具有最高的能量
C.有效碰撞是活化分子在一定方向上的碰撞
D.活化分子的平均能量称之活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4 L CCl4中含CCl4分子数为NA
B. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
C. 0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D. 3.9 g Na2O2 晶体中含有的离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求书写
![]() 系统命名是________________________________
系统命名是________________________________
2—甲基—1,3-丁二烯的结构简式 __________________________________
(2)下列各对物质中属于同系物的是___________________,属于同分异构体的是____________属于同位素的是__________,属于同素异形体的是___________
A ![]() C与
C与![]() C B O2与O3
C B O2与O3
C  D
D 
E  与
与
(3)下列属于苯的同系物的是____________________(填字母)。
A  B
B ![]() C
C ![]() D
D 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) ![]() 2NH3(g)△H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
2NH3(g)△H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.

回答下列问题:
(1)已知:①NH3(l)═NH3(g)△H1,②N2(g)+3H2(g) ![]() 2NH3(l)△H2;则反应N2(g)+3H2(g)
2NH3(l)△H2;则反应N2(g)+3H2(g) ![]() 2NH3(g)的△H=_____________(用含△H1、△H2的代数式表示);
2NH3(g)的△H=_____________(用含△H1、△H2的代数式表示);
(2)合成氨的平衡常数表达式为____________,平衡时,M点NH3的体积分数为10%,则N2的转化率为____________(保留两位有效数字) ;
(3)X轴上a点的数值比b点____________(填“大”或“小”)。上图中,Y轴表示____________(填“温度”或“压强”),判断的理由是____________;
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示:
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
Ⅰ | 恒温恒容 | 放热Q1kJ |
Ⅱ | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
下列判断正确的是____________;
A.放出热量:Ql<Q2<△Hl B.N2的转化率:Ⅰ>Ⅲ
C.平衡常数:Ⅱ>Ⅰ D.达平衡时氨气的体积分数:Ⅰ>Ⅱ
(5)常温下,向VmL amol/L的稀硫酸溶液中滴加等体积bmol/L的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)____________c(SO42-)(填“>”、“<”或“=”) ;
(6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-,写出负极的电极反应式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是
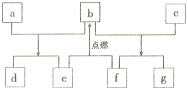
A. 简单离子的半径:Y>Z>X
B. 简单氢化物的沸点:Y>X
C. 最高价氧化物对应水化物的碱性:Z>Y
D. W、Y的氧化物所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
I.利用下列装置制备NaNO2
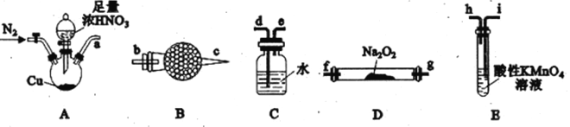
已知:①2NO+Na2O2=2NaNO2;②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。请回答下列问题:
(1)利用上图中的装置制备NaNO2,其连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)实验开始时,先通一段时间N2的目的是__________。
(3)装置B中盛放试剂的名称为__________,装置C的作用是__________。
(4)装置E中发生反应的离子方程式为____________________。
Ⅱ.测定上述实验所制备的NaNO2样品(含NaNO3杂质)的纯度。称量D中所得样品ag溶解后配制成250mL溶液取25.00mL于锥形瓶中,用bmoL-1酸性高锰酸钾溶液滴定到终点。重复上述滴定操作两次,测得数据如下表:
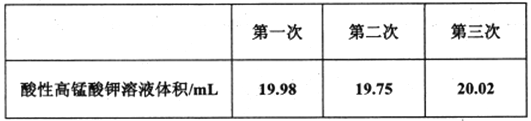
(5)滴定终点的实验现象为_________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是__________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2的质量分数为__________(用含a、b的关系式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com