
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。

回答下列问题:
(1)甲的分子式为 __________。
(2)丙中含有官能团的名称是__________。
(3)反应①的反应类型是________;反应②的反应类型是_______。
(4)反应④的化学方程式_______。
(5)符合下列条件的乙的同分异构体共有______种。
①能发生银镜反应
②能与NaHCO3溶液反应,且1mol乙与足量NaHCO3溶液反应时产生气体22.4L(标准状况)。
写出其中在核磁共振氢谱中峰面积之比为1∶6∶2∶1的一种同分异构体的结构简式:________。(任意一种)
(6)设计以![]() (丙酮)、乙醇、乙酸为原料制备
(丙酮)、乙醇、乙酸为原料制备![]() (2,4—戊二醇)的合成路线(无机试剂任选)_______。
(2,4—戊二醇)的合成路线(无机试剂任选)_______。
【答案】C6H11Br 醛基、羰基(酮基) 消去反应 氧化反应 ![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O 12
+H2O 12  或
或  CH3CH2OH
CH3CH2OH![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
![]()
【解析】
甲的分子式为C6H11Br,经过过程①,变为C6H10,失去1个HBr,C6H10经过一定条件转化为乙,乙在CH3SCH3的作用下,生成丙,丙经过②过程,在CrO3的作用下,醛基变为羧基,发生氧化反应,丙经过③过程,发生酯化反应,生成丁为![]() ,丁经过④,在一定条件下,生成
,丁经过④,在一定条件下,生成![]() 。
。
(1)甲的分子式为C6H11Br,故答案为:C6H11Br;
(2) 丙的结构式为 含有官能团为醛基、羰基(酮基),故答案为:醛基、羰基(酮基);
含有官能团为醛基、羰基(酮基),故答案为:醛基、羰基(酮基);
(3) C6H11Br,失去1个HBr,变为C6H10,为消去反应;丙经过②过程,在CrO3的作用下,醛基变为羧基,发生氧化反应,故答案为:消去反应;氧化反应;
(4)该反应的化学方程式为,![]() ,故答案为:
,故答案为:![]() ;
;
(5) 乙的分子式为C6H10O3。①能发生银镜反应,②能与NaHCO3溶液反应,且1mol乙与足量NaHCO3溶液反应时产生气体22.4L(标准状况)。说明含有1个醛基和1个羧基,满足条件的有:当剩余4个碳为没有支链,羧基在第一个碳原子上,醛基有4种位置,羧基在第二个碳原子上,醛基有4种位置;当剩余4个碳为有支链,羧基在第一个碳原子上,醛基有3种位置,羧基在第二个碳原子上,醛基有1种位置,共12种,其中核磁共振氢谱中峰面积之比为1∶6∶2∶1的一种同分异构体的结构简式 或
或  ,故答案为:12;
,故答案为:12; 或
或  ;
;
(6)根据过程②,可将CH3CH2OH中的羟基氧化为醛基,再将醛基氧化为羧基,羧基与醇反生酯化反应生成酯,酯在一定条件下生成![]() ,
,![]() 再反应可得
再反应可得![]() ,合成路线为CH3CH2OH
,合成路线为CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
![]()
![]()
![]() ,故答案为:CH3CH2OH
,故答案为:CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
![]()
![]()
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料。已知A在标准状况下的密度为1.25g·L-1,B、D是生活中常见的两种有机物。它们之间的转化关系如图所示:
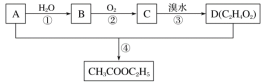
请回答:
(1)有机物A的结构简式为_____________,有机物C中含有的官能团的名称是_____________。
(2)写出B和D反应的化学方程式:_____________。
(3)下列说法正确的是_____________。
a.石油裂解是工业上大量获得烃A的主要方法
b.相同条件下,有机物B与钠反应比水与钠反应更剧烈
c.用浓NaOH溶液可除去混在乙酸乙酯中的B、D杂质
d.有机物A与D在一定条件下生成乙酸乙酯的反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼 (N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为_______,第一电离能最大的元素为_______。
(2)钛的原子序数为22,其基态电子排布式示意图为________________。
(3)1 mol N2H4分子中含有的键数目为_______。
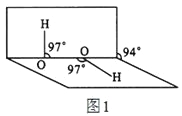
(4)H2O2分子结构如图1,其中心原子杂化轨道为_______,估计它难溶于CS2,简要说明原因___________。
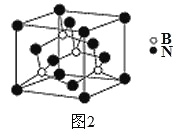
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为___,若立方氮化硼的密度为ρ g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )

A. 1∶1∶2B. 2∶2∶1
C. 1∶2∶2D. 9∶2∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着环境污染的加重和人们环保意识的加强,生物降解材料逐渐受到了人们的关注。以下是PBA(一种生物降解聚酯高分子材料)的合成路线:

已知:①烃A的相对分子质量为84,核磁共振氢谱显示只有1组峰,不能使溴的四氯化碳溶液褪色。
②化合物C中只含一个官能团。
③R1CH=CHR2 ![]() R1COOH+R2COOH。
R1COOH+R2COOH。
④RC≡CH+ →
→ 。
。
请回答下列问题:
(1)由A生成B的反应类型为______________。
(2)由B生成C的化学方程式为____________________________。
(3)E的结构简式为____________________________________。
(4)F的名称为__________(用系统命名法);由D和F生成PBA的化学方程式为____________________________;
(5)E的同分异构体中能同时满足下列条件的共有_________种。(不含立体异构)
①链状化合物②能发生银镜反应③氧原子不与碳碳双键直接相连
其中,核磁共振氢谱显示为2组峰,且峰面积比为2∶1的是_________(写结构简式)。
(6)若由1,3丁二烯为原料(其他无机试剂任选)通过三步制备化合物F,其合成路线为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是
A. 该反应可能在空气中进行B. 另一种化合物是NaCl
C. Na的还原性强于金刚石D. 这个反应是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的化工原料,以乙烯、丙烯为原料衍生出部分化工产品的反应如图(部分反应条件及产物已略去):

(1)CH2=CH2生成A的化学方程式为______________
(2)有机物B的结构简式为_______,所含官能团名称为__________
(3)写出B生成C的化学方程式________________
(4)CH2=CH2生成![]() 的反应类型为_____
的反应类型为_____
(5)写出D+CE的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2、LiFePO4、LiMnO2、Cu与磷的化合物等都是研究电池的常用材料。请回答下列问题。
(1)Co4+中存在__种不同能量的电子。
(2)你预测第一电离能:Cu__Zn(填“>”或“<”)。请说出你的理由:__。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
表格中卤化物的熔点产生差异的原因是:___。
(4)直链多磷酸盐的阴离子有复杂的结构,焦磷酸根离子、三磷酸根离子结构如图:

这类磷酸根离子的化学式可用通式表示为___(用n代表P原子数)。
(5)钴蓝晶胞结构如图1所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成如图2,则钴蓝晶体的化学式为___。在晶体中,某些原子位于其它原子围成的空隙中,如图3中●原子就位于最近的4个原子围成的正四面体空隙中。在钴蓝晶体中,Al3+位于O2-形成的___空隙中。若阿伏加德罗常数用NA表示,则钴蓝晶体的密度为___g·cm-3(列计算式即可,不必化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com