
【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
【答案】HF CaCO3、Al(OH)3 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 该反应的 K=3.5×105,可以认为该反应进行完全 冷却结晶 过滤洗涤 6HF+Na2SO4+NaAlO2=Na3AlF6+H2SO4+2H2O 负 2Cl--2e-=Cl2↑ 氯气
【解析】
含锂电解铝废渣主要成分为LiF、AlF3、NaF,少量CaO等,加入浓硫酸生成的气体为HF,浸取后过滤分离出滤渣为CaSO4,滤液中加碳酸钠发生2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑、2Li++CO32-=Li2CO3,气体为二氧化碳,过滤分离出滤液含硫酸钠,分离出氢氧化铝、Li2CO3,再加CaO、苛化反应将不溶性的碳酸锂转化成氢氧化锂溶液,过滤分离出滤渣2含碳酸钙,碳化时LiOH与二氧化碳反应生成Li2CO3,二氧化碳在流程中可循环使用,以此来解答。
(1)根据上述分析,废渣与浓硫酸反应产生的气体化学式为HF,根据上述分析,滤渣2的主要成分是CaCO3、Al(OH)3,故答案为:HF;CaCO3、Al(OH)3;
(2)碱解反应中,同时得到气体和沉淀反应是铝离子与碳酸根离子的双水解反应,离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(3)Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)的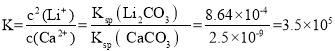 >105,可以认为该反应进行完全,故答案为:该反应的 K=3.5×105,可以认为该反应进行完全;
>105,可以认为该反应进行完全,故答案为:该反应的 K=3.5×105,可以认为该反应进行完全;
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、冷却结晶、过滤洗涤、干燥,故答案为:冷却结晶、过滤洗涤;
(5)根据流程图知,反应物为HF、Na2SO4、NaAlO2,生成物为Na3AlF6,根据原子守恒及反应原理书写方程式为:6HF+Na2SO4+NaAlO2=Na3AlF6+H2SO4+2H2O,故答案为:6HF+Na2SO4+NaAlO2=Na3AlF6+H2SO4+2H2O;
(6)根据图示C极有Li生成,电极反应为:Li++ e-=Li,则C为阴极,发生还原反应,应连接电源的负极;阳极发生氧化反应,根据图示阳极有氯气生成,则电极反应式为:2Cl--2e-=Cl2↑;根据图示分析,该方法设计的 A 区能用熔融的碳酸锂吸收产生的氯气,防止氯气对还原产生污染,故答案为:负; 2Cl--2e-=Cl2↑;氯气。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。

回答下列问题:
(1)甲的分子式为 __________。
(2)丙中含有官能团的名称是__________。
(3)反应①的反应类型是________;反应②的反应类型是_______。
(4)反应④的化学方程式_______。
(5)符合下列条件的乙的同分异构体共有______种。
①能发生银镜反应
②能与NaHCO3溶液反应,且1mol乙与足量NaHCO3溶液反应时产生气体22.4L(标准状况)。
写出其中在核磁共振氢谱中峰面积之比为1∶6∶2∶1的一种同分异构体的结构简式:________。(任意一种)
(6)设计以![]() (丙酮)、乙醇、乙酸为原料制备
(丙酮)、乙醇、乙酸为原料制备![]() (2,4—戊二醇)的合成路线(无机试剂任选)_______。
(2,4—戊二醇)的合成路线(无机试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知食盐常加入KIO3 来补充碘元素,检验食盐中是否加碘,可利用如下反应:__KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反应方程式)。
①利用上述反应检验食盐中是否加碘,所需试剂是________(填下列选项的序号)
A、碘水B、KI溶液C、淀粉溶液D、稀硫酸E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为___________
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl2 1.5mol,则被氧化的NH3在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体X通入溶液A(如下图,尾气吸收装置略)中,实验现象能够支持结论的是
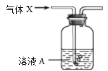
选项 | 气体X | 溶液A及反应现象 | 结论 |
A. | 乙醇与浓硫酸共热170℃产生的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
B. | 电石与饱和食盐水反应产生的气体 | KMnO4酸性溶液紫色逐渐变浅 | 乙炔被高锰酸钾酸性溶液氧化 |
C. | 溴乙烷与氢氧化钠醇溶液共热生成的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
D. | 碳酸钠固体与醋酸溶液反应产生的气体 | 苯酚钠溶液中出现白色沉淀 | 碳酸的酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述中正确的是( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应2H2 (g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是( )
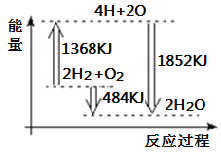
A. 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量
B. 拆开2molH2 (g)和1mol O2 (g)中的化学键成为H、O原子,共放出1368kJ能量
C. 2molH2 (g)和1molO2 (g)反应生成2mol H2O(g),共放出484 kJ能量
D. 2molH2 (g)和1molO2 (g)反应生成2molH2O(l),共吸收484 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
A![]() B
B![]() C
C![]() D
D
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___。
②在工业生产中B气体的大量排放被雨水吸收后形成了___而污染了环境。
(2)若A在常温下为无色无味气体,C是红棕色的气体
①A、C的化学式分别是:A___;C___。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式:___。该反应___(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语能正确表示相应意义的是( )
A. 乙烯的结构简式CH2CH2B. 丁烷的结构简式CH3(CH2)2CH3
C. 四氯化碳的电子式![]() D. 苯的分子式
D. 苯的分子式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CuS、Cu2S处理酸性废水中的Cr2O![]() ,发生反应如下:
,发生反应如下:
反应Ⅰ:CuS+Cr2O![]() +H+→Cu2++SO
+H+→Cu2++SO![]() +Cr3++H2O(未配平)
+Cr3++H2O(未配平)
反应Ⅱ:Cu2S+Cr2O![]() +H+→Cu2++SO
+H+→Cu2++SO![]() +Cr3++H2O(未配平)
+Cr3++H2O(未配平)
下列有关说法正确的是( )
A.反应Ⅰ和Ⅱ中Cu2+、SO![]() 都是氧化产物
都是氧化产物
B.处理1molCr2O![]() 时反应Ⅰ、Ⅱ中消耗H+的物质的量相等
时反应Ⅰ、Ⅱ中消耗H+的物质的量相等
C.反应Ⅱ中还原剂、氧化剂的物质的量之比为3:5
D.反应Ⅰ、Ⅱ中每处理1molCr2O![]() ,转移电子数不相等
,转移电子数不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com