
【题目】如图为反应2H2 (g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是( )
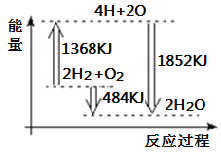
A. 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量
B. 拆开2molH2 (g)和1mol O2 (g)中的化学键成为H、O原子,共放出1368kJ能量
C. 2molH2 (g)和1molO2 (g)反应生成2mol H2O(g),共放出484 kJ能量
D. 2molH2 (g)和1molO2 (g)反应生成2molH2O(l),共吸收484 kJ能量
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是
A. 该反应可能在空气中进行B. 另一种化合物是NaCl
C. Na的还原性强于金刚石D. 这个反应是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,南极上空出现大面积的臭氧空洞。氟利昂-12对臭氧层有很强的破坏力,它的分子结构相当于甲烷分子中,有两个氢原子被氯原子取代,另外两个氢原子被氟原子取代。下列叙述正确的是()
A.有两种同分异构体
B.是平面型分子
C.只有一种结构
D.有四种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管试验”具有简易、方便、节约、绿色等优点。观察下列四个“封管试验”(夹持装置未画出),判断下列说法正确的是( )
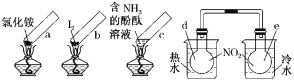
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.水浴时,d内气体颜色变浅,e内气体颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数。已知C2H4和C4H8的混合物的质量为ag ,下列说法正确的( )
A. 燃烧时消耗的O2一定是33.6a/14 LB. 所含碳氢键数目为2aNA/7
C. 所含氢原子总数为3aNA/14D. 所含共用电子对数目为3a NA /14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法不正确的是( )
A.常温常压下,18g18O2所含的质子数为8NA
B.1mol氢氧根离子中含有的电子数为NA
C.氢氧燃料电池中转移1mol电子消耗0.5molH2
D.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F七种元素,试按如下所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大,且原子半径:A>B>C;
②D、E是非金属元素,它们与氢化合可生成气态氢化物HD和H2E,室温下,D的单质是黄绿气体,E的单质是淡黄色固体;
③F是非金属性最强的元素
(1)A在加热条件下生成的氧化物的电子式为___,含有的化学键类型有___,D在元素周期表的位置是___。
(2)用电子式表示B、D元素形成的化合物的形成过程:___。
(3)比较D和E的氢化物稳定性强弱:___(填化学式)。D、E、F简单离子半径由大到小为___(填离子符号)。
(4)C的最高价氧化物对于的水化物的化学式为___;和A的最高价氧化物对应的水化物反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
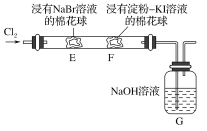
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH-+Cl2===ClO-+Cl-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com