
【题目】有A、B、C、D、E、F七种元素,试按如下所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大,且原子半径:A>B>C;
②D、E是非金属元素,它们与氢化合可生成气态氢化物HD和H2E,室温下,D的单质是黄绿气体,E的单质是淡黄色固体;
③F是非金属性最强的元素
(1)A在加热条件下生成的氧化物的电子式为___,含有的化学键类型有___,D在元素周期表的位置是___。
(2)用电子式表示B、D元素形成的化合物的形成过程:___。
(3)比较D和E的氢化物稳定性强弱:___(填化学式)。D、E、F简单离子半径由大到小为___(填离子符号)。
(4)C的最高价氧化物对于的水化物的化学式为___;和A的最高价氧化物对应的水化物反应的离子方程式为___。
【答案】![]() 离子键和共价键 第三周期第ⅦA族
离子键和共价键 第三周期第ⅦA族 ![]() HCl>H2S S2->Cl->F- Al(OH)3 Al(OH)3+OH-=
HCl>H2S S2->Cl->F- Al(OH)3 Al(OH)3+OH-=![]() +2H2O
+2H2O
【解析】
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,即处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,可推知A为Na,B为Mg,C为Al;
②D、E是非金属元素,它们与氢化合可生成气态氢化物HD和H2E,D、E分别表现-1、-2价,室温下,D的单质是黄绿气体,E的单质是淡黄色固体,则D为Cl元素,E为S元素;
③F是非金属性最强的元素,周期表中最右上角的元素非金属最强,即F是F元素;故A、B、C、D、E、F分别为:Na、Mg、Al、Cl、S、F。
(1) A在加热条件下生成的氧化物是Na2O2,电子式为:![]() ;含有的化学键类型:离子键和共价键;D是Cl元素,在元素周期表的位置是:第三周期第ⅦA族;
;含有的化学键类型:离子键和共价键;D是Cl元素,在元素周期表的位置是:第三周期第ⅦA族;
(2) B、D元素形成的化合物是MgCl2,用电子式表示形成过程:![]() ;
;
(3) D、E分别为Cl、S,同周期从左到右,非金属性增强,则Cl>S,氢化物稳定性越稳定,故HCl>H2S;同周期的简单离子半径随原子序数的增大而减小,随电子层数大的离子半径大,即:S2->Cl->F-,故答案为:HCl>H2S;S2->Cl->F-;
(4) C是Al,其最高价氧化物对于的水化物的化学式为:Al(OH)3;A的最高价氧化物对应的水化物为NaOH,两者反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,离子方程式为:Al(OH)3+OH-=![]() +2H2O
+2H2O


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.CO2催化加氢制甲醇是极具前景的资源化研究领域,主要反应有:
i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1
ii.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
iii.CO(g)+2H2(g)![]() CH3OH(g) ΔH3
CH3OH(g) ΔH3
(1)ΔH3=___kJ·mol-1。
(2)已知反应i的速率方程为v正=k正x(CO2)·x3(H2),v逆=k逆·x(CH3OH)·x(H2O),k正、k逆均为速率常数且只与温度有关,x为物质的量分数。其物质的量分数平衡常数Kx=___(以k正、k逆表示)。
(3)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
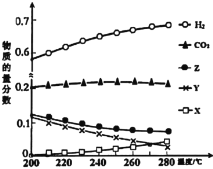
①图中Y代表___(填化学式)。
②250℃时反应ii的Kx___1(填“>”、“<”或“=”)
③下列措施中,一定无法提高甲醇产率的是___。
A.加入适量CO B.使用催化剂
C.循环利用原料气 D.升高温度
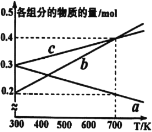
(4)在10MPa下将H2、CO按一定比例投料,平衡状态时各组分的物质的量与温度的关系如图所示。曲线b代表的物质为____(填化学式)。温度为700K时,该反应的平衡常数KP=___(MPa)-2(结果用分数表示)。
Ⅱ.在恒容容器中,使用某种催化剂对反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0
SO3(g)+NO(g) ΔH<0
进行相关实验探究。改变投料比[n(SO2):n(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]实验结果如图所示。
已知:KR=16,KZ=![]() 。
。
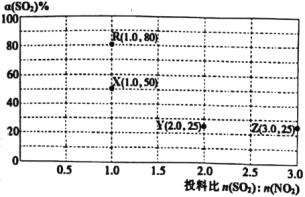
(5)如果要将图中R点的平衡状态改变为X点的平衡状态。应采取的措施是___。
(6)通过计算确定图中R、X、Y、Z四点中温度相等的点是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应2H2 (g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是( )
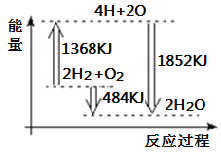
A. 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量
B. 拆开2molH2 (g)和1mol O2 (g)中的化学键成为H、O原子,共放出1368kJ能量
C. 2molH2 (g)和1molO2 (g)反应生成2mol H2O(g),共放出484 kJ能量
D. 2molH2 (g)和1molO2 (g)反应生成2molH2O(l),共吸收484 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )
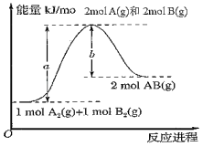
A.每生成2molAB(g)吸收的热量为(a﹣b)kJ
B.该反应是放热反应
C.1molA2(g)和1molB2(g)具有的总能量大于2molAB(g)具有的总能量
D.断裂1molA﹣A键和1molB﹣B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语能正确表示相应意义的是( )
A. 乙烯的结构简式CH2CH2B. 丁烷的结构简式CH3(CH2)2CH3
C. 四氯化碳的电子式![]() D. 苯的分子式
D. 苯的分子式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)①工业合成氨反应:N2+3H2![]() 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
②已知断开1molN![]() N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2
N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2![]() 2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
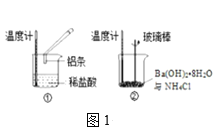
(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度___(填“升高”或“降低”)。反应过程___(填“①”或“②”)的能量变化可用图2表示。
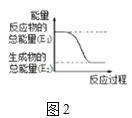
(3)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图2所示,该反应是___(填“吸热”或“放热”)反应。
(4)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示:

①则d电极是___(填“正极”或“负极”),c电极的电极反应式为___。
②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
B. 标准状况下,2.24LSO3中所含原子数为0.4 NA
C. 常温常压下,16gO2和O3的混合气体中所含原子数目为NA
D. 在一定条件下lmolN2与3molH2反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定环境中,下列各组离子一定可以大量共存的是
A.某无色溶液:Fe2+、NO![]() 、SO
、SO![]() 、Na+
、Na+
B.使紫色石蕊试液变红的溶液:NH![]() 、Mg2+、Cl-、K+
、Mg2+、Cl-、K+
C.加入铝粉放出氢气的溶液:Na+、Cl-、NH![]() 、NO3-
、NO3-
D.使无色酚酞试液显红色的溶液:S2-、K+、HCO![]() 、Al3+
、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成n mol Z,同时生成n mol X
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com