
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )
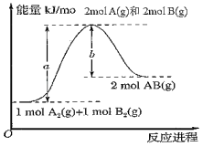
A.每生成2molAB(g)吸收的热量为(a﹣b)kJ
B.该反应是放热反应
C.1molA2(g)和1molB2(g)具有的总能量大于2molAB(g)具有的总能量
D.断裂1molA﹣A键和1molB﹣B键,放出akJ能量
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)0.1mol某烷烃完全燃烧,消耗标准状况下的O2 11.2L,其分子式为__________。
(2)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为__________。
(3)某有机物的结构表达式为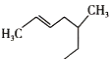 ,其名称是__________。
,其名称是__________。
(4)萘的结构简式为![]() ,它的二氯代物有__________种。
,它的二氯代物有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管试验”具有简易、方便、节约、绿色等优点。观察下列四个“封管试验”(夹持装置未画出),判断下列说法正确的是( )
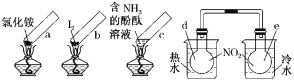
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.水浴时,d内气体颜色变浅,e内气体颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数。已知C2H4和C4H8的混合物的质量为ag ,下列说法正确的( )
A. 燃烧时消耗的O2一定是33.6a/14 LB. 所含碳氢键数目为2aNA/7
C. 所含氢原子总数为3aNA/14D. 所含共用电子对数目为3a NA /14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法不正确的是( )
A.常温常压下,18g18O2所含的质子数为8NA
B.1mol氢氧根离子中含有的电子数为NA
C.氢氧燃料电池中转移1mol电子消耗0.5molH2
D.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法中正确的是( )
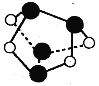
A.0.5mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S-S键
B.合成氨工业中,投料1mol[N2(g)+3H2(g)]可生成2NA个[NH3(g)]
C.用惰性电极电解1L浓度均为2molL-1的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子发生转移时,阴极析出6.4g金属
D.273K,101kPa下,1mol过氧化氢分子中含有的共用电子对数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F七种元素,试按如下所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大,且原子半径:A>B>C;
②D、E是非金属元素,它们与氢化合可生成气态氢化物HD和H2E,室温下,D的单质是黄绿气体,E的单质是淡黄色固体;
③F是非金属性最强的元素
(1)A在加热条件下生成的氧化物的电子式为___,含有的化学键类型有___,D在元素周期表的位置是___。
(2)用电子式表示B、D元素形成的化合物的形成过程:___。
(3)比较D和E的氢化物稳定性强弱:___(填化学式)。D、E、F简单离子半径由大到小为___(填离子符号)。
(4)C的最高价氧化物对于的水化物的化学式为___;和A的最高价氧化物对应的水化物反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基磺酸(H2NSO3H)是一元固体强酸,俗称“固体硫酸”,易溶于水和液氨,不溶于乙醇,在工业上常用作酸性清洗剂、阻燃剂、磺化剂等。某实验室用尿素和发烟硫酸(溶有SO3的硫酸)制备氨基磺酸的流程如图:
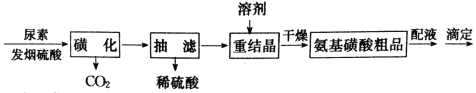
已知“磺化”步骤发生的反应为:
①CO(NH2)2(s)+SO3(g)![]() H2NCONHSO3H(s) ΔH<0
H2NCONHSO3H(s) ΔH<0
②H2NCONHSO3H+H2SO4![]() 2H2NSO3H+CO2↑
2H2NSO3H+CO2↑
发生“磺化”步骤反应的装置如图1所示:请回答下列问题:
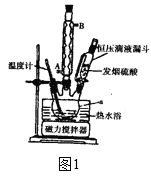
(1)下列关于“磺化”与“抽滤”步骤的说法中正确的是____。
A.仪器a的名称是三颈烧瓶
B.冷凝回流时,冷凝水应该从冷凝管的B管口通入
C.抽滤操作前,应先将略小于漏斗内径却又能将全部小孔盖住的滤纸平铺在布氏漏斗中,稍稍润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上,再转移悬浊液
D.抽滤结束后为了防止倒吸,应先关闭水龙头,再拆下连接抽气泵和吸滤瓶之间的橡皮管
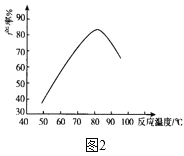
(2)“磺化”过程温度与产率的关系如图2所示,控制反应温度为75~80℃为宜,若温度高于80℃,氨基磺酸的产率会降低,可能的原因是____。
(3)“抽滤”时,所得晶体要用乙醇洗涤,则洗涤的具体操作是____。
(4)“重结晶”时,溶剂选用10%~12%的硫酸而不用蒸馏水的原因是____。
(5)“配液及滴定”操作中,准确称取2.500g氨基磺酸粗品配成250mL待测液。取25.00mL待测液于锥形瓶中,以淀粉-碘化钾溶液做指示剂,用0.08000molL-1的NaNO2标准溶液进行滴定,当溶液恰好变蓝时,消耗NaNO2标准溶液25.00mL。此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。
①电子天平使用前须____并调零校准。称量时,可先将洁净干燥的小烧杯放在称盘中央,显示数字稳定后按____,再缓缓加样品至所需质量时,停止加样,读数记录。
②试求氨基磺酸粗品的纯度:____(用质量分数表示)。
③若以酚酞为指示剂,用0.08000molL-1的NaOH标准溶液进行滴定,也能测定氨基磺酸粗品的纯度,但测得结果通常比NaNO2法____(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2![]() 4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
A. v(NO)=0.1 mol·(L·s)-1 B. v(NO)=0.02 mol·(L·s)-1
C. v(NH3)=0.01 mol·(L·s)-1 D. v(NH3)=0.2 mol·(L·s)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com