
【题目】按要求填空:
(1)0.1mol某烷烃完全燃烧,消耗标准状况下的O2 11.2L,其分子式为__________。
(2)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为__________。
(3)某有机物的结构表达式为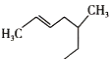 ,其名称是__________。
,其名称是__________。
(4)萘的结构简式为![]() ,它的二氯代物有__________种。
,它的二氯代物有__________种。
【答案】C3H8 6 5-甲基-2-庚烯 10
【解析】
本题主要考察有机物的基础内容,比如燃烧反应的通式、同分异构体的确定、烯烃的系统命名法。
(1)11.2L的O2有0.5mol,烷烃的燃烧通式为:![]() ,则有
,则有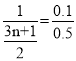 ,解得n=3,所以该物质的分子式为C3H8;
,解得n=3,所以该物质的分子式为C3H8;
(2)烷基的通式为CnH2n+1,则有14n+1=43,解得n=3,即该烷基为丙基:![]() 和
和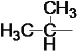 ,烷基可以在甲基的邻、间、对位上,故该芳香烃产物有6种;
,烷基可以在甲基的邻、间、对位上,故该芳香烃产物有6种;
(3)将该结构“拉直”并标号为:![]() ,故该物质的系统命名为5-甲基-2-庚烯;
,故该物质的系统命名为5-甲基-2-庚烯;
(4)萘环的碳原子编号为: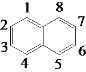 ,先定一个Cl原子的位置在1号碳原子上,则另外一个Cl原子可以在2、3、4、5、6、7、8号碳原子上;再定一个Cl原子在2好碳原子上,则另外一个Cl原子可以在3、6、7号碳原子上;故萘的二氯取代产物有10种结构。
,先定一个Cl原子的位置在1号碳原子上,则另外一个Cl原子可以在2、3、4、5、6、7、8号碳原子上;再定一个Cl原子在2好碳原子上,则另外一个Cl原子可以在3、6、7号碳原子上;故萘的二氯取代产物有10种结构。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molHClO中所含H—Cl键的数目为NA
B. 8.8g乙酸乙酯中所含碳原子数为0.4NA
C. 1.2gC与0.1molCO2在高温下充分反应生成的CO分子数为0.1NA
D. 标准状况下,1L0.1mol·L-1HCl溶液中滴加氨水至pH=7,溶液中![]() 的数目为0.1NA
的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟验证CO2与Na2O2反应的产物,现设计以下实验装置进行实验:
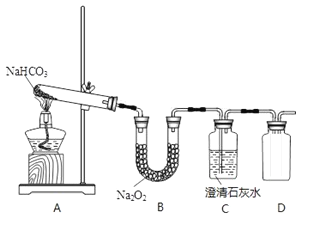
(1)写出装置A中反应的化学方程式________。
(2)写出装置B中反应的化学方程式________。
(3)拟用装置D收集气体产物,请将装置补充完整________。
(4)产物检验:检验气体产物的方法________。
(5)检验固体产物的方法:从B装置中取少量固体,溶于水配成溶液,________。
(6)有同学认为该实验装置存在明显缺陷,你认为该缺陷是什么________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学物质丰富多彩,化学反应精彩纷呈,在生活和生产中应用广泛。
(1)盛放氢氧化钠的玻璃试剂瓶不用玻璃塞,请用化学方程式表示其中的原因:___;
(2)工业上制备粗硅的化学方程式为:___;
(3)可用氢氧化钠溶解铝土矿(主要成分Al2O3);其反应方程式为:___;
(4)铁锈(主要成分氧化铁)与稀盐酸反应___;
(5)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列说法正确的是( )
]。下列说法正确的是( )
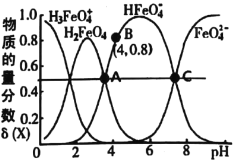
A.K2FeO4、H2FeO4都属于强电解质
B.由B点数据可知,H2FeO4的第一步电离常数Ka1=4.0×10-4
C.25℃,H2FeO4(aq)+H+![]() H3FeO4+(aq)的平衡常数K>100
H3FeO4+(aq)的平衡常数K>100
D.A、C两点对应溶液中水的电离程度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CO2催化加氢制甲醇是极具前景的资源化研究领域,主要反应有:
i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1
ii.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
iii.CO(g)+2H2(g)![]() CH3OH(g) ΔH3
CH3OH(g) ΔH3
(1)ΔH3=___kJ·mol-1。
(2)已知反应i的速率方程为v正=k正x(CO2)·x3(H2),v逆=k逆·x(CH3OH)·x(H2O),k正、k逆均为速率常数且只与温度有关,x为物质的量分数。其物质的量分数平衡常数Kx=___(以k正、k逆表示)。
(3)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
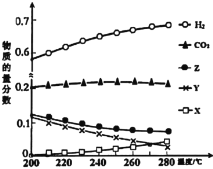
①图中Y代表___(填化学式)。
②250℃时反应ii的Kx___1(填“>”、“<”或“=”)
③下列措施中,一定无法提高甲醇产率的是___。
A.加入适量CO B.使用催化剂
C.循环利用原料气 D.升高温度
(4)在10MPa下将H2、CO按一定比例投料,平衡状态时各组分的物质的量与温度的关系如图所示。曲线b代表的物质为____(填化学式)。温度为700K时,该反应的平衡常数KP=___(MPa)-2(结果用分数表示)。
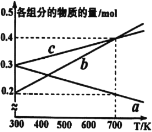
Ⅱ.在恒容容器中,使用某种催化剂对反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0
SO3(g)+NO(g) ΔH<0
进行相关实验探究。改变投料比[n(SO2):n(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]实验结果如图所示。
已知:KR=16,KZ=![]() 。
。
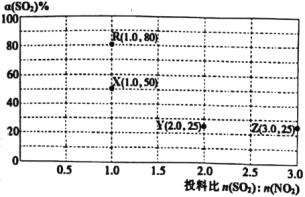
(5)如果要将图中R点的平衡状态改变为X点的平衡状态。应采取的措施是___。
(6)通过计算确定图中R、X、Y、Z四点中温度相等的点是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的装置图能够达到实验目的是( )
A. 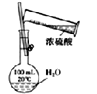 配制一定浓度的稀硫酸
配制一定浓度的稀硫酸
B. 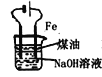 实验室制备Fe(OH)2
实验室制备Fe(OH)2
C. 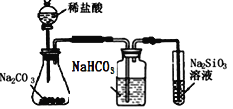 比较氯、碳、硅三种元素的非金属性强弱
比较氯、碳、硅三种元素的非金属性强弱
D.  加热熔融NaOH固体
加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )
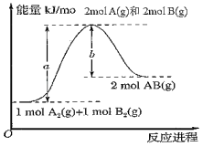
A.每生成2molAB(g)吸收的热量为(a﹣b)kJ
B.该反应是放热反应
C.1molA2(g)和1molB2(g)具有的总能量大于2molAB(g)具有的总能量
D.断裂1molA﹣A键和1molB﹣B键,放出akJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com