
【题目】下列实验事实能说明HNO2是弱电解质的是
①HNO2溶液与NaHCO3溶液混合,放出气泡
②用HNO2溶液做导电性实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1mol·L -1HNO2溶液中,c(H+)=0.015mol·L-1
⑤相同浓度时,HNO2溶液的导电能力比盐酸弱
⑥取0.1mol·L -1HNO2溶液200mL,加水至体积为2L,pH>2
A.①②③B.④⑤⑥C.①③④D.①④⑤⑥
【答案】B
【解析】
①HNO2溶液 与NaHCO3溶液混合,放出气泡,只能说明HNO2具有酸性,不能判断HNO2是否属于弱电解质,故不符合题意;
②用HNO2溶液做导电性实验,灯泡很暗,只能说明溶液中可移动离子浓度较低,因不确定HNO2的浓度,因此无法判断HNO2是否属于弱电解质,故不符合题意;
③HNO2溶液不与Na2SO4溶液反应,只能说明二者能够大量共存,无法判断HNO2是否属于弱电解质,故不符合题意;
④0.1mol·L -1HNO2溶液中,c(H+)=0.015mol·L-1,说明HNO2未发生完全电离,可说明HNO2属于弱电解质,故符合题意;
⑤HNO2和盐酸二者均为一元酸,相同浓度时,HNO2溶液导电能力弱说明HNO2在溶液中未发生完全电离,可说明HNO2属于弱电解质,故符合题意;
⑥取0.1mol·L -1HNO2溶液200mL,加水至体积为2L,稀释后的HNO2浓度为![]() ,此时溶液pH>2,说明HNO2在溶液中未发生完全电离,可说明HNO2属于弱电解质,故符合题意;
,此时溶液pH>2,说明HNO2在溶液中未发生完全电离,可说明HNO2属于弱电解质,故符合题意;
故答案为:B。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.C60 和 C70互为同位素
B.N2 、N3- 、N4、N5+互为同素异形体
C.立方烷(![]() )和苯乙烯互为同分异构体
)和苯乙烯互为同分异构体
D.CH3CH2COOH 和HCOOCH2CH2CH3 互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为测定化合物Co(NH3)yClx(其中Co为+3价)的组成,进行如下实验。
(1)氯的测定:准确称取2.675g该化合物,配成溶液后用1.00mol·L-1AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀(Ag2CrO4为砖红色)且不再消失时,消耗AgNO3溶液30.00mL。[已知:Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.12×10-12]
①AgNO3标准溶液需要放在棕色的滴定管中的原因是__。(用化学方程式表示)
②若滴定终点读数时滴定管下口悬挂了一滴液体,会使得测定结果__。(填“偏大”、“偏小”、“无影响”)
③用K2CrO4溶液作指示剂的理由是__。
(2)氨的测定:再准确称取2.675g该化合物,加适量水溶解,注入如图4___。(填仪器名称)中,然后通过仪器3滴加足量的NaOH溶液,加热1装置,产生的氨气被5中的盐酸吸收,多余的盐酸再用NaOH标准溶液反滴定,经计算,吸收氨气消耗1.00mol·L-1盐酸60.00mL。

装置A在整个实验中的作用是__,如果没有6中的冰盐水,会使得测定结果___(填“偏大”、“偏小”、“无影响”)。
(3)通过处理实验数据可知该化合物的组成为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯稍有水果气味,用于配制香水香精和人造精油,也大量用于食品中,实验室制备方法如下:

Ⅰ苯甲酸乙酯粗产品的制备
在干燥的50 mL三颈圆底烧瓶中,加入6.1g苯甲酸、过量无水乙醇、8 mL苯和1mL浓硫酸,摇匀后加沸石,安装分水器。水浴加热,开始控制回流速度1~2 d/s。反应时苯一乙醇﹣水会形成“共沸物”蒸馏出来。加热回流约1小时,至分水器中不再有小水珠生成时,停止加热。改为蒸馏装置,蒸出过量乙醇和苯。
沸点(℃) | 相对分子质量 | |
苯甲酸 | 249 | 122 |
苯甲酸乙酯 | 212.6 | 150 |
(1)写出苯甲酸与用18O标记的乙醇酯化反应的方程式___________________。
(2)装置A的名称及冷水通入口_________________________。
(3)通过分水器不断分离除去反应生成的水,目的是___________________。还有什么方法可以实现同样的目的_____________(任答两种)。
(4)实验过程中没有加沸石,请写出补加沸石的操作___________________。
(5)图二装置中的错误______________________。
Ⅱ.苯甲酸乙酯的精制
将苯甲酸乙酯粗产品用如下方法进行精制:将烧瓶中的液体倒入盛有30 mL冷水的烧杯中,搅拌下分批加入饱和Na2CO3溶液(或研细的粉末),至无气体产生,pH试纸检测下层溶液呈中性。用分液漏斗分出粗产物,水层用乙醚(10 mL)萃取。合并有机相,用无水CaCl2干燥。干燥后的粗产物先用水浴蒸除乙醚,再改用减压蒸馏,收集馏分。
(6)加入饱和碳酸钠溶液除了可以降低苯甲酸乙酯溶解度外,还有的作用是__________。
(7)按照纠正后的操作进行,测得产品体积为5mL(苯甲酸乙酯密度为1.05gcm﹣3)。实验的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
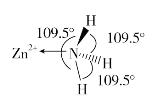
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________。
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
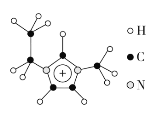
大π键可用符号Π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________。
(5)Zn与S形成某种化合物的晶胞如图所示。
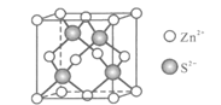
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VA族元素在生产、生活中有重要用途。回答下列问题:
(1)三聚磷酸钠(俗称“五钠”常用于食品生产中,作水分保持剂、品质改良剂等。
①磷酸的结构式如图所示,其主要的电离方程式为______________。
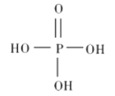
②三聚磷酸是三分子磷酸脱去两分子水后的产物,三聚磷酸钠的化学式为_______________。
(2)在碱性条件下,次磷酸盐(H2PO2-)可用于化学镀银,写出其反应的离子方程式______________。(氧化产物与还原产物物质的量之比为1:4)
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
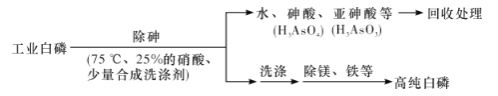
①除砷过程在75 ℃下进行,其合理的原因是____________(填字母代号)。
a,使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,增大反应速率
②硝酸氧化除砷时被还原为NO,写出砷转化为亚砷酸的化学方程式:______________________________。
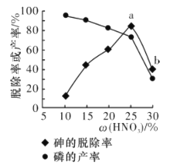
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是__________________。
(4)常温下银氨溶液中存在平衡:Ag+(aq) + 2NH3(aq) ![]() Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)
Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
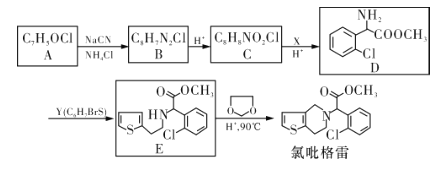
【题目】氯吡格雷(Clopidogrel)是一种用于抑制血小板聚集的药物。以A为原料合成氯吡格雷的路线如下:
已知: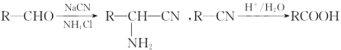 。
。
请回答下列问题:
(1)A中含氧官能团的名称为___________,C→D的反应类型是_____________。
(2)Y的结构简式为___________,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有_______种。
(3)C分子间可在一定条件下反应生成含有3个六元环的产物,该反应的化学方程式为_________________________________。
(4)由E转化为氯吡格雷时,生成的另一种产物的结构简式为_______________。
(5)写出A的所有同分异构体(芳香族化合物)的结构简式:___________________(只有一个环、不考虑立体异构)。
(6)请结合题中信息写出以![]() 为有机原料制备化合物
为有机原料制备化合物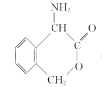 的合成路线流程图(无机试剂任选)。______________________________________________。合成流程图示例如下:
的合成路线流程图(无机试剂任选)。______________________________________________。合成流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比。当电解装置插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀。根据上述现象,下列选项说法正确的是( )
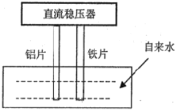
A.通电时,铝片做阳极,铁片做阴极
B.生成的气泡、红棕色或灰绿色的沉淀都是电解的直接或间接产物
C.通过对比,确实能说明自来水中含有大量对人体有毒有害的物质
D.铁片的电极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源电解制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向。下列说法正确的是( )
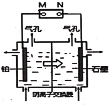
A.M发生的电极反应为PbO2+SO42-+4H+=PbSO4+2H2O
B.左侧气孔逸出的气体可能为副产物O2
C.电解槽中发生的总反应为:2MnSO4+2H2O![]() 2Mn+O2↑+2H2SO4
2Mn+O2↑+2H2SO4
D.若用阳离子交换膜代替阴离子交换膜,阴极可能得到MnO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com