
【题目】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
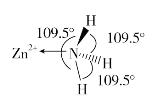
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________。
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
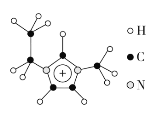
大π键可用符号Π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________。
(5)Zn与S形成某种化合物的晶胞如图所示。
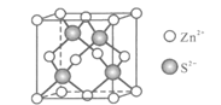
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
【答案】3d10 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成键电子对之间的排斥作用,排斥作用减弱,所以H-N-H键键角变大 Π![]() 离子晶体 3d轨道上没有未成对电子(或3d轨道为全空或全满状态) 正四面体 否
离子晶体 3d轨道上没有未成对电子(或3d轨道为全空或全满状态) 正四面体 否  ×1010-a
×1010-a
【解析】
(1)基态Zn的电子排布式为1s22s22p63s23p63d104s2,由此可确定Zn2+的价电子排布式。
(2)解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°,可从电子对的排斥作用寻找原因。
(3)EMIM+离子中形成大π键的原子有5个,其中3个C原子、2个N原子,参与形成大π键的电子数为6。化合物[EMIM][AlCl4],由[EMIM]+、[AlCl4]-构成,由此可确定该物质的晶体类型。
(4)通过对Sc3+、Cr3+、Fe2+、Zn2+四种离子的核外电子进行分析,得出Sc3+、Zn2+的水合离子为无色的原因。
(5)①四个S2-构成正四面体结构,Zn2+体积很小,填入S2-组成的空隙中;
②由①无法判断出S2-、Zn2+是否相切;已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,可通过建立一个正四面体,确定一个三角形,计算Zn2+半径。
(1) 基态Zn的电子排布式为1s22s22p63s23p63d104s2,则基态Zn2+的价电子排布式为3d10。答案为:3d10;
(2)在独立的NH3分子中,N原子的孤电子对排斥成键电子对的能力强,[Zn(NH3)6]2+中,N原子的孤电子对转化为成键电子对,对其它三个成键电子对的排斥作用减弱,键角增大。
从而得出解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成键电子对之间的排斥作用,排斥作用减弱,所以H-N-H键键角变大。答案为:氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成键电子对之间的排斥作用,排斥作用减弱,所以H-N-H键键角变大;
(3) EMIM+离子中形成大π键的原子有5个,其中3个C原子、2个N原子,参与形成大π键的电子数为6,EMIM+离子中的大π键应表示为Π![]() 。化合物[EMIM][AlCl4],由[EMIM]+、[AlCl4]-构成,则晶体类型为离子晶体。答案为:Π
。化合物[EMIM][AlCl4],由[EMIM]+、[AlCl4]-构成,则晶体类型为离子晶体。答案为:Π![]() ;离子晶体;
;离子晶体;
(4)通过对Sc3+、Cr3+、Fe2+、Zn2+四种离子的核外电子进行分析发现,得出Sc3+、Zn2+的电子排布式为1s22s22p63s23p6、1s22s22p63s23p63d10,3d轨道为全空和全满,而另两种离子,3d轨道都存在未成对电子,由此得出水合离子为无色的原因是3d轨道上没有未成对电子(或3d轨道为全空或全满状态)。答案为:3d轨道上没有未成对电子(或3d轨道为全空或全满状态);
(5)①四个S2-构成正四面体结构,Zn2+体积很小,填入S2-组成的正四面体空隙中;答案为:正四面体;
②由①分析,我们不能得出S2-、Zn2+是否相切。

由晶胞结构我们可以得出:晶胞中含S2-的个数为4,含Zn2+的个数为8×![]() +6×
+6×![]() =4,所以晶体的体积为
=4,所以晶体的体积为![]() =
=![]() cm3,晶胞边长为
cm3,晶胞边长为 cm。
cm。
四个Zn2+在体内四个小正四面体的中心,不在同一平面内,过b点向上面作垂线,构成三角形,两边分别为![]() x、
x、![]() x,即可求出斜边为
x,即可求出斜边为![]() x(x为晶胞边长),则a位置S2-离子与b位置Zn2+之间的距离为
x(x为晶胞边长),则a位置S2-离子与b位置Zn2+之间的距离为![]() x,从而得出 a+r(Zn2+)=
x,从而得出 a+r(Zn2+)=![]()
 ×1010pm,r(Zn2+)=(
×1010pm,r(Zn2+)=(![]()
 ×1010-a)pm。答案为:否;
×1010-a)pm。答案为:否;![]()
 ×1010-a。
×1010-a。


科目:高中化学 来源: 题型:
【题目】二氧化碳捕集与封存是应对气候变化问题的解决方案之一。回答下列问题:
(l)我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将CO2和CH4一步转化为化工产品。试写出 CO2与CH4合成乙酸的热化学方程式:____。
(甲烷和乙酸的燃烧热分别为-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一钢性密闭容器中CH4、CO2的分压分别为15 kPa、20 kPa,加入Ni/α-Al2 O3催化剂并加热至1123 K使其发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.28![]() 10-2﹒p(CH4)
10-2﹒p(CH4)![]() p(CO2)(kPa
p(CO2)(kPa![]() s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa
s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa![]() s-1。
s-1。
②达到平衡后测得体系压强是起始时的![]() ,则该反应的平衡常数Kp=____kPa)2。
,则该反应的平衡常数Kp=____kPa)2。
(3)氮化镓(GaN)与Cu可组成如图所示的人工光合系统,该装置能以CO2和H2O为原料合成CH4。
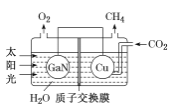
①该装置工作时H+移向____(填“GaN”或“Cu”)电极,该电极上的电极反应式为 ___。
②该装置每产生1 mol CH4,左极室溶液质量减少____g。
③本实验条件下,若CO2转化为烃(如甲烷、乙烯等)的转化率为10%,生成CH4的选择性为12%,现收集到12 mol CH4,则通入的CO2为____mol。(已知:选择性=生成目标产物消耗的原料量/原料总的转化量)
(4)上述人工光合系统装置也可以制备乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面选择加氢的反应机理,如下图所示。其中吸附在Pd表面的物质用“*”标注。
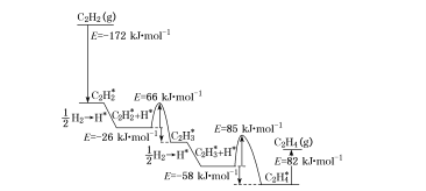
上述吸附反应为 ____填“吸热”或“放热”)反应,该过程中最小能垒(活化能)为___ kJ![]() mol-1,该步骤的化学方程式为____。
mol-1,该步骤的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:

(1)小明同学用图中的发生、收集装置。甲、乙两试管各有两根导管,连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体。则稀硫酸应置于____中(填“甲”或“乙”);G管可以用化学实验室里的一种常用仪器代替,你认为这种仪器的名称是____。仪器甲、乙接口的连接方式如下:A连接___,C连接F;(填写接口的编号)
(2)小李同学用沉淀法测定Na2SO3的质量分数。
操作流程:

①操作Ⅱ的名称是_______。
②操作Ⅰ之前,为判断所加BaCl2溶液是否过量, 设计如下方案,其中最合理的是___。
A.取少量上层清液,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
B.待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量。
C.待浊液澄清后,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
③根据以上数据得出Na2SO3的质量分数为_____。
④小丽同学经认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,请你推测可能的原因是______,验证方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
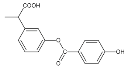
①分子式为C16H14O5 ②能使酸性高锰酸钾溶液褪色 ③能发生加成反应,但不能发生取代反应 ④苯环上的一溴代物有6种 ⑤1mol 该有机物与NaOH反应时最多消耗4mol NaOH ⑥1mol该有机物在一定条件下和H2反应,共消耗6molH2
A.①②③⑥B.①②③⑤C.①③④⑤⑥D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明许多疾病,包括基因突变(癌变、动脉硬化等)和生物机体中毒等,可能是一氧化氮的释放或调节不正常引起的。用间接电化学法可对NO进行无害化处理,其原理如图所示(质子膜允许H+和H2O通过),下列相关判断不正确的是 ( )
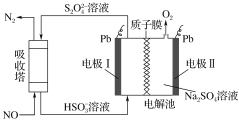
A.电极Ⅰ接电源负极,电极反应式为2HSO3-+2H++2e-==S2O42-+2H2O
B.质子从电极Ⅱ通过质子膜向电极Ⅰ作定向移动
C.吸收塔中的反应为2NO+2S2O42-+2H2O==N2+4HSO3-
D.每处理2 mol NO,电解池质量减少32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实能说明HNO2是弱电解质的是
①HNO2溶液与NaHCO3溶液混合,放出气泡
②用HNO2溶液做导电性实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1mol·L -1HNO2溶液中,c(H+)=0.015mol·L-1
⑤相同浓度时,HNO2溶液的导电能力比盐酸弱
⑥取0.1mol·L -1HNO2溶液200mL,加水至体积为2L,pH>2
A.①②③B.④⑤⑥C.①③④D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水中存在电离平衡:H2OH++OH- △H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)增大
D.将水加热,KW增大,pH减小,酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个固定体积均为1 L密闭容器中以不同的氢碳比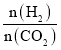 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法正确的是 ( )
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法正确的是 ( )
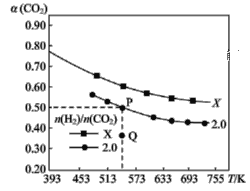
A.该反应在常温下不可能自发进行
B.氢碳比,X<2.0
C.若起始时CO2、H2浓度分别为0.5 mol·L-1、1.0 mol·L-1,则可得P点对应温度的平衡常数的值为512
D.向P点状态的容器中,按2∶4∶1∶4的比例再充入CO2、H2、C2H4、H2O,再次平衡后α(CO2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.碳酸氢钠的水解方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O
C.用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO+2H+=H2SiO3↓+2Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com