
【题目】下列指定反应的离子方程式正确的是( )
A.碳酸氢钠的水解方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O
C.用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO+2H+=H2SiO3↓+2Na+
科目:高中化学 来源: 题型:
【题目】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
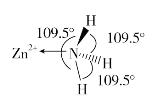
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________。
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
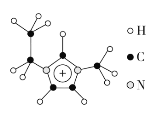
大π键可用符号Π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________。
(5)Zn与S形成某种化合物的晶胞如图所示。
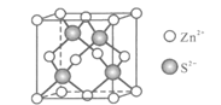
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时有关弱电解质的电离平衡常数:
弱电解质化学式 | CH3COOH | NH3·H2O | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
在25℃时,下列有关电解质溶液的说法不正确的是
A.pH相等的四种溶液a. CH3COONa b.Na2CO3 c. NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.1L 0.50mol·L-1NH4Cl溶液与2L0.25mo·L-1NH4Cl溶液,前者含NH4+物质的量多
D.浓度均为0.1mol·L-1的CH3COOH、CH3 COONa混合溶液中: c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A.ClO的空间构型为直线形
B.SiF4和 SO3的中心原子均为 sp3杂化
C.在所有的元素中,氟的第一电离能最大
D.C2H5OH 分子中共含有 8 个极性键,1 个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A.NH4Cl+NaOH ![]() NH3↑+NaCl+H2O
NH3↑+NaCl+H2O
B.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.Na2O2+2H2O=2NaOH+H2O2
D.SO2+H2O=H2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源电解制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向。下列说法正确的是( )
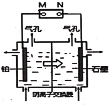
A.M发生的电极反应为PbO2+SO42-+4H+=PbSO4+2H2O
B.左侧气孔逸出的气体可能为副产物O2
C.电解槽中发生的总反应为:2MnSO4+2H2O![]() 2Mn+O2↑+2H2SO4
2Mn+O2↑+2H2SO4
D.若用阳离子交换膜代替阴离子交换膜,阴极可能得到MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析不正确的是( )

A.V=20
B.b点所示溶液中:c(NH4+)>2c(SO42-)>c(H+)>c(OH-)
C.d点所溶液中:c(NH4+)+c(OH-)=2c(SO42-)+c(H+)
D.NH3·H2O的电离常数K≈2×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2。在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_____。
(2)500℃该反应的平衡常数为_____(结果保留一位小数)。
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)____v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业废气和汽车尾气中含有多种氮氧化物,主要是NO 和NO2,都以NOx来表示。NOx能破坏臭氧层,产生光化学烟雾,是造成大气污染的主要来源之一。回答下列问题:
(1)已知 1mol 分子分解为单个原子所需要的能量为解离焓。 N2(g)、NO(g)、O2(g)的解离焓分别为941.7、631.8、493.7(单位kJ/mol),计算反应 2NO(g) = N2(g) + O2(g)的△H=_______kJ/mol,试判断NO(g)常温、常压下能否自发分解 ________填能或不能)。
(2)为防止光化学烟雾,除从工厂、汽车的设计进行改进外,也要采用某些化学方法。用焦炭还原NOx 的反应为2NOx(g) + xC(s)N2(g) + xCO2(g)
Ⅰ.在恒温条件下,2 molNO2(g)和足量 C(s)反应,测得平衡时 NO2(g)和 CO2(g)的物质的量浓度与平衡总压的关系如图所示:
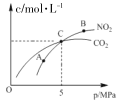
①A、B两点NO2平衡转化率的关系α(A)____α(B),平衡常数关系K(A)_____K(B)(填>、<或=)。
②计算C点时该反应的压强平衡常数Kp=_____MPa(Kp是用平衡分压代替平衡浓度)计算,分压=总压×物质的量分数)。
Ⅱ.现在向容积均为 2L 的两个密闭容器A、B中加入一定量的 NO(g)和足量的C(s),相同温度下测得两容器中n(NO)随时间变化情况如表所示:
0 | 20 | 40 | 60 | 80 | |
n(NO)/mol(A) | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
n(NO)/mol(B) | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
B容器内反应在 100s时达到平衡状态,则0~100s内用 NO 表示的平均反应速率为v(NO)= ____________。
(3)近年来电化学方法在处理氮氧化物方面也起到了一定的作用,如图是一种氨气一二氧化氮燃料电池,常温下可将二氧化氮转化为氮气。

①c口通入的气体为______ ,写出负极反应的方程式 ________。
②若a、d口产生的气体体积共为1.568L(标况下),电路中通过的电子数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com