
【题目】25℃时,水中存在电离平衡:H2OH++OH- △H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)增大
D.将水加热,KW增大,pH减小,酸性增强
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.用氨水吸收过量的二氧化硫:![]()
B.向0.5mol L-1 KAl(SO4)2溶液中滴入0.5mol L-1 Ba(OH)2溶液使![]() 恰好完全沉淀:2Ba2+ 4OH- + Al3++2
恰好完全沉淀:2Ba2+ 4OH- + Al3++2![]() =2BaSO4↓+
=2BaSO4↓+![]() +2H2O
+2H2O
C.用足量Na2S2O3溶液除去水中的 Cl2: 4Cl2+![]() +5H2O =10H++2
+5H2O =10H++2![]() +8Cl-
+8Cl-
D.少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O→C6H5OH+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________
4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________![]() 填字母代号
填字母代号![]() 。
。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2V逆(NO2)=V正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
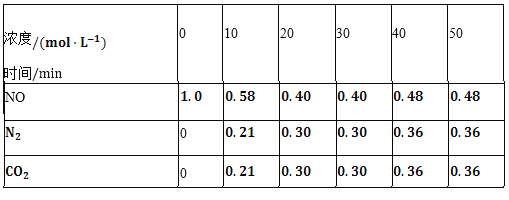
①根据表中数据分析T1℃时,该反应在0~20min的平均反应速率v(CO2)________;计算该反应的平衡常数![]() ________。
________。
②根据上表数据判断,由30min到40min时改变的条件可能是________![]() 任写一种
任写一种![]() 。
。
③若30min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,此时NO的转化率________![]() 填“升高”或“降低”
填“升高”或“降低”![]() ,△H________
,△H________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。(3)以
。(3)以![]() 与
与![]() 为原料可合成化肥尿素化学式为
为原料可合成化肥尿素化学式为![]() 。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
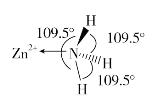
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________。
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
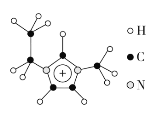
大π键可用符号Π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________。
(5)Zn与S形成某种化合物的晶胞如图所示。
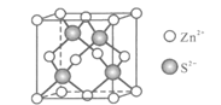
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图。下列说法正确的是
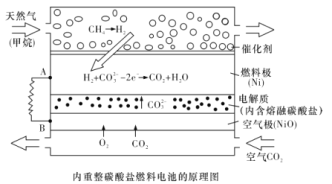
A.以此电池为电源电解饱和食盐水,当有0.2 mol e-转移时,阳极产生2.24 L气体
B.若以甲烷为燃料气时负极电极反应式:CH4+5O2- - 8e - =CO32- +2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生的电极反应式为O2+4e- +2CO2 =2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷(Clopidogrel)是一种用于抑制血小板聚集的药物。以A为原料合成氯吡格雷的路线如下:
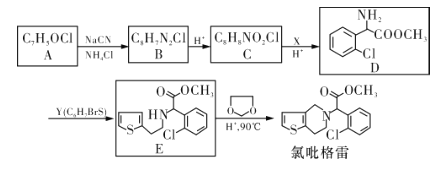
已知: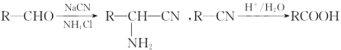 。
。
请回答下列问题:
(1)A中含氧官能团的名称为___________,C→D的反应类型是_____________。
(2)Y的结构简式为___________,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有_______种。
(3)C分子间可在一定条件下反应生成含有3个六元环的产物,该反应的化学方程式为_________________________________。
(4)由E转化为氯吡格雷时,生成的另一种产物的结构简式为_______________。
(5)写出A的所有同分异构体(芳香族化合物)的结构简式:___________________(只有一个环、不考虑立体异构)。
(6)请结合题中信息写出以![]() 为有机原料制备化合物
为有机原料制备化合物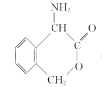 的合成路线流程图(无机试剂任选)。______________________________________________。合成流程图示例如下:
的合成路线流程图(无机试剂任选)。______________________________________________。合成流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时有关弱电解质的电离平衡常数:
弱电解质化学式 | CH3COOH | NH3·H2O | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
在25℃时,下列有关电解质溶液的说法不正确的是
A.pH相等的四种溶液a. CH3COONa b.Na2CO3 c. NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.1L 0.50mol·L-1NH4Cl溶液与2L0.25mo·L-1NH4Cl溶液,前者含NH4+物质的量多
D.浓度均为0.1mol·L-1的CH3COOH、CH3 COONa混合溶液中: c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析不正确的是( )

A.V=20
B.b点所示溶液中:c(NH4+)>2c(SO42-)>c(H+)>c(OH-)
C.d点所溶液中:c(NH4+)+c(OH-)=2c(SO42-)+c(H+)
D.NH3·H2O的电离常数K≈2×10-5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com