
����Ŀ���й�������ŵ����2020�꣬��λGDP������̼�ŷű�2005���½�40%��50%��CO2��ת�����л���ʵ��̼ѭ������Ч����̼�ŷš�
��1�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2��һ�������·�Ӧ��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)����H����49.0 kJmol��1�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)��H2O(g)����H����49.0 kJmol��1�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ��ʾ��
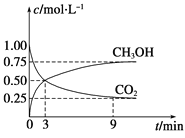
�ټ��㣺��0min��3min��H2��ƽ����Ӧ����v(H2)��_______mol��L��1��min��1����Ӧ��ƽ��ʱ���ų���������_______kJ��
����˵��������Ӧ�ﵽƽ��״̬����________(����)��
A��c(CO2) ��c(CH3OH)��1��1
B�����������ܶȲ��ٷ����仯
C����λʱ��������3mol H2��ͬʱ����1mol H2O
D��CO2����������ڻ�������б��ֲ���
�۷�Ӧ�ﵽƽ����������������䣬�ܼӿ췴Ӧ������ʹ��ϵ����������ʵ������٣��ɲ�ȡ�Ĵ�ʩ��________(����)��
A�������¶� B����С�������
C���ٳ���CO2���� D��ʹ�ú��ʵĴ���
��2����֪A(g)��B(g) ![]() C(g)��D(g) ��H����Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)��D(g) ��H����Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.7 | 1.1 | x | 0.6 | 0.4 |
�ش��������⣺
�ٸ÷�Ӧ��_____��Ӧ������ȡ������ȡ�)��
��830��ʱ����һ��2L���ܱ������г���0.20mol��A��0.80mol��B����Ӧ��10sʱ�ﵽƽ�⣬���A��ת����Ϊ80%������830��ʱ����Ӧ��ƽ�ⳣ��x��____��
���𰸡� 0.5 36.75 D B ���� 1
��������������Ҫ���黯ѧƽ����жϡ�Ӱ�컯ѧƽ���������ؼ��й�ƽ�ⳣ���ļ��㡣
��1����v(H2)��3v(CO2)=3��0.50/3mol��L��1��min��1=0.5mol��L��1��min��1����Ӧ��ƽ��ʱ������CO20.75mol���ų���������0.75��49.0kJ=36.75kJ��
��A��c(CO2) ��c(CH3OH)�Ĺ�ϵ��ƽ��״̬֮��û�й�ϵ ����A����˵��������Ӧ�ﵽƽ��״̬ ��B����������������䣬������䣬���Ի��������ܶ�ʼ�ղ��䣬��B����˵��������Ӧ�ﵽƽ��״̬ ��C����������Ӧ���ʣ���C����˵��������Ӧ�ﵽƽ��״̬ �� D��CO2������������ŷ�Ӧ���ж��仯����CO2����������ڻ�������б��ֲ���ʱ ��������Ӧ�ﵽƽ��״̬����D��˵��������Ӧ�ﵽƽ��״̬ ����ѡD��
�� A�������¶�ƽ�����ƣ��������ʵ������ӣ���A���������⣻B����ѹ��Ӧ��������ƽ�����ƣ���B�������⣻C���������ʵ������࣬��C���������⣻D��ƽ�ⲻ�ƶ����������ʵ������䣬��D���������⡣��ѡB��
��2����ƽ�ⳣ�������¶����߶���С�����Ը÷�Ӧ�Ƿ��ȷ�Ӧ��
��830��ʱ��������ƽ��Ũ��Ϊc(A)=0.02mol/L��c(B)=(0.80-0.16)/2mol/L=0.32mol/L��c(C)=c(D)=0.08mol/L��x��[c(C)c(D)]/[ c(A)c(B)]=1��


 Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д� �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ��ά����A�ķ��ӽṹ��ά����A�еĺ����������� _________�������ƣ���ά����A�ķ���ʽ�� ___________��1molά����A�������_______mol�巢���ӳɷ�Ӧ��
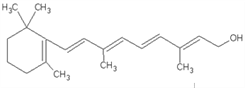
��2����������������ͬ���칹�����______________����ͬϵ�����_____________�����ڴ�����____________���˴Ź����������շ���4�����������Ϊ1��2��2��3����_____________��
��CH3CH2CH2CH3 ��CH3CH2CH3 ��CH3CH2OH ��CH3COOH ��CH3CH2COOH ��![]() ��
��![]() �� CH2=CHCH=CH2 ��CH��CCH2CH3
�� CH2=CHCH=CH2 ��CH��CCH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe2+�pNO3-�pNH4+�pFe3+��H+- H2O������,�ֱ�����һ��������ԭ��Ӧ�еķ�Ӧ���������,���������������( )
A. ����1mol NO3-�μӻ�ԭ��Ӧ,��ת��8mole- B. ��ԭ����ΪNH4+
C. �������뻹ԭ�������ʵ���֮��Ϊ8:1 D. �÷�Ӧ��Fe2+������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ã���������ȡ�۲�Fe(OH)2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6 mol��L��1�����ᣬ�����Լ���ѡ��
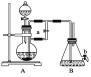
��д���пհף�
(1)B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ�����Լ���________��A�з�Ӧ�����ӷ���ʽ��___________________________��
(2)ʵ�鿪ʼʱӦ�Ƚ�����a________(�������������ر���)��
(3)��������Fe(OH)2�IJ������̣�________________________��
(4)ʵ����ϣ���b������������һ���ֿ�������ʱB�з�����Ӧ�Ļ�ѧ����ʽΪ__________________��
(5)��ͼ��________�ܽϳ�ʱ�俴��Fe(OH)2��ɫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ���ǣ� ��
A.NaCl��ҺB.������Һ
C.CuSO4��ҺD.�������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�Ķ������������������ϣ�
����һ
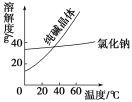
���϶�
���� | �۵�/�� | �е�/�� | �ܶ�/ g/cm3 | �ܽ��� |
�Ҷ���(C2H6O2) | ��11.5 | 198 | 1.11 | ������ˮ���Ҵ� |
������(C3H8O3) | 17.9 | 290 | 1.26 | �ܸ�ˮ���ƾ�������Ȼ��� |
�ش���������(����ĸ���)��
��1���Ӻ�����NaCl��Na2CO3���ᴿNa2CO3�IJ���Ϊ�ܽ⡢_________��________�����ˡ�ϴ�ӡ�����
��2�����Ҷ����ͱ�������������ѷ�����_________��
A��������������B����ȡ�� C���ᾧ�� D����Һ��
II.����������õĵֿ�ű����ҩ��ɴӻƻ��ᆬҶ����ȡ��������ɫ��״���壬�������Ҵ������ѵ��л��ܼ���������ˮ����������ȡ��������
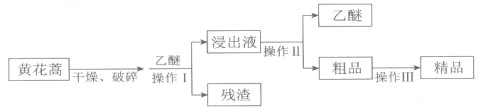
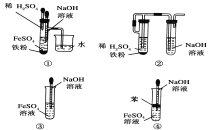
����I��II�У������õ���װ����________������ţ���
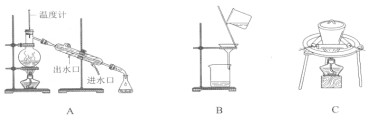
��.ʵ������98%���ܶ�Ϊ1.84g/cm3��Ũ��������0.2mol/L��H2SO4��Һ470mL.
��1����Ҫʹ�õ���Ҫ��������Ͳ���ձ�����������___________��__________��
��2�����������ɷֽ�Ϊ���¼�����
A������Ͳ��ȡ______mLŨ���ᣬ����ע��װ��Լ50mL����ˮ���ձ�����ò��������衣
B������������ˮ������ϴ���ձ��Ͳ���������ÿ�ε�ϴҺ����������ƿ�
C����ϡ�ͺ������С�ĵ��ò�������������ƿ�
D���������ƿ�Ƿ�©ˮ��
E��������ˮֱ�Ӽ�������ƿ����Һ��ӽ��̶���1-2cm����
F���ǽ�ƿ���������ߵ���ҡ����Һ��
G���ý�ͷ�ι�������ƿ����μ�������ˮ����Һ����͵�ǡ����������С�
��ݴ���д��
��������������еĿհ״���
�ڲ��������ȷ�IJ���˳������ĸ��д����____________
�� D ������ A ���� �� �� �� ���� F ����
��3�����в�����ʹ����ϡ����Ũ��ƫ�ߵ���______________��
A��ȡ��Ũ����ʱ���ӿ̶���
B������ƿ������ˮϴ�Ӻ���1.2mol/L��������ϴ
C��ת����Һʱ��������������Һ����
D������ʱ��������ƿ�̶���
E����ϡ�ͺ��ϡ��������ת������ƿ�ҽ��к����ʵ�����
F�����ݺ�����ƿ����ҡ�ȣ����ź���Һ����ڿ̶��ߣ��ֲ��伸�� ����ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.01mol��L-1 �Ĵ�����Һ�������������1mol��L-1������Ũ�ȵ����ӣ���һ��ʱ����ʼ�ձ��ּ�С���Ƶ���
A. c(H+) B. c(CH3COO-)
C. c(H+)/c(CH3COOH)�ı�ֵ D. c(CH3COOH)/c(H+)�ı�ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д���пհף�
(1)����6.02��1023��H��H2O�������ʵ�����________mol��ij��������Һ�к���3.01��1023��Na+������Һ��SO42-�����ʵ����� ____________mol������Һ��Na2SO4������Ϊ ______________g��
(2)_____________mol H2O�к��е���ԭ������1.5 mol CO2�к��е���ԭ������ȡ�
(3)�������ʵ�����NH3��CH4��ϣ����������NH3��CH4��������Ϊ______________��
(4)��֪16gA��20gBǡ����ȫ��Ӧ����0.04molC��31.76gD����C��Ħ������Ϊ ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com