
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_________________________。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中均含有的溶质是________(填化学式),写出该溶质的一种用途:________。
【答案】Al2O3+6H+ =2Al3++3H2O SiO2+20H-=SiO32-+H2O 硫氰化钾溶液 NaHCO3 治疗胃酸过多
【解析】
由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有氢氧化钠、偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为氢氧化钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3,滤液K中含有NaHCO3,据此判断。
根据以上分析可知A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,C为氢氧化铁、氢氧化镁,D含有氢氧化钠、偏铝酸钠、氯化钠,E中含有NaCl、NaHCO3,F为Al(OH)3,X为Fe2O3、MgO等,Y为氢氧化钠、偏铝酸钠,Z为Al(OH)3,K中含有NaHCO3,则:
(1)Al2O3与盐酸反应生成氯化铝和水,氧化物不能拆,离子方程式为:Al2O3+6H+ =2Al3++3H2O;
(2)二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,二氧化硅不能拆,故离子反应方程式为:SiO2+20H-=SiO32-+H2O;
(3)Fe3+与硫氰化钾溶液反应,使溶液变红色,检验滤液B中是否含Fe3+离子的方法为:取少量滤液B,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+;
(4)根据以上分析可知滤液E、K中均含有的溶质是碳酸氢钠,碳酸氢钠可用于治疗胃酸过多、制纯碱或做发酵粉等。


科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质的结构。请回答下列问题。
(1)已知X和Y为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/(kJ/mol) | I1 | I2 | I3 | I4 |
X | 578 | 1817 | 2745 | 11578 |
Y | 738 | 1451 | 7733 | 10540 |
X通常显_____价,X的电负性____Y的电负性(填“>”“ =”或“<”)。
(2)紫外光的光子所具有的能量约为399kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:_______________。
共价键 | C-C键 | C-N键 | C-S键 |
键能/(kJ/mol) | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子的杂化类型是__________。
(3)实验证明:KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似(如图),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/(kJ.mol-1) | 786 | 715 | 3401 |
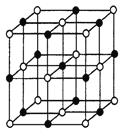
则这四种离子晶体的熔点从高到低的顺序是_______。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有______个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型化合物V2O5和CrO2中,适合作录音带磁粉原料的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组需配制含有NH![]() 、Cl-、K+、SO42—的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
、Cl-、K+、SO42—的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
(1)该植物培养液中,NH![]() 的物质的量浓度为_____________。
的物质的量浓度为_____________。
(2)该研究小组配制该植物培养液时,还须用到的实验仪器是________(填字母)。
A.450 mL容量瓶 B.500 mL容量瓶 C.两个250 mL容量瓶
(3)甲同学用KCl和(NH4)2SO4两种物质进行配制,则需称取m(KCl)=____g,m[(NH4)2SO4]=___g。
(4)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是_________(填选项)。
A.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
C.用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线
D.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在组成生物体的各种元素中,下列组合中均属于大量元素的是
A. C、H、0、Zn B. P、S、Mg C. C、H、K、Fe D. O、N、P、Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:

(1)仪器组装完成后,夹好止水夹,__________________________________,则说明装置A的气密性良好。
(2)下列实验步骤中,正确的操作顺序是____________(填序号)。
①打开止水夹;②熄灭C处的酒精喷灯;③C处冷却至室温后,关闭止水夹;④点燃C处的酒精喷灯;⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是 ______。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
D.若固体全部溶解,再滴加KSCN溶液,溶液变红色,说明样品一定含有Fe2O3
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,证明样品中一定含有________,写出产生上述气体的化学方程式:____________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体6.400g,测得滤液中Fe2+有2.000mol,则样品中n(Cu2O)=________________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。

(1)向苦卤中通入Cl2是为了提取溴,发生反应的离子方程式为________________。
(2)富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为______________________。也可用纯碱吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1 mol Br2时,转移的电子为________ mol。
(3)下列有关海水综合利用的说法错误的是____。
A.粗盐可采用除杂和重结晶等过程提纯
B.电解饱和食盐水可制得金属钠
C.工业生产常选用Ca(OH)2作为沉淀剂
D.海水提镁涉及到复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com