
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ������һ��ԭ����CH3OH��g����H2O��g����Ӧ����CO2��H2 �� ͼ�Ǹù����������仯ʾ��ͼ�����ڷ�Ӧ��ϵ�м����������Ӧ������������Ӧ��� a�ı仯�������������С���������䡱������Ӧ�ȡ�H�ı� ���������������С���������䡱������д����Ӧ����CH3OH��g����H2O��g����Ӧ���Ȼ�ѧ����ʽ �� 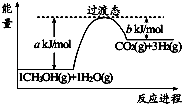
���𰸡���С�����䣻CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol��
���������⣺�������ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ���a��С�����������ܸı��ܣ�����Ӧ�ȡ�H���䣬��Ӧ����ͼ������������������ڷ�Ӧ�������������Ϊ���ȷ�Ӧ����ͼ��֪��1mol �״���1mol ˮ������Ӧ����CO2���������յ�����Ϊ��a��b��kJ����Ӧ�Ȼ�ѧ����ʽΪ��CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol��
���Դ��ǣ���С�����䣻CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol��
�����㾫����ͨ������������ȷ�Ӧ�ͷ��ȷ�Ӧ�����ջ�ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ�����Խ����⣮


 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҩ���й��Ŵ��Ĵ���֮һ������ǡ�������ľ̿�۾��Ȼ�϶��ɣ���ȼ����ܷ����ķ�Ӧ��S+2KNO3+3C=N2��+3CO2��+X������ƽ����������X��
A. K2S B. SO2 C. H2S D. SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ�Ͻ��м��������������Һ���õ�NO2��N2O4��NO������壬��Ӧ����Һ�м���2mol/LNaOH��Һ��������ǡ����ȫ�������õ���NO2��N2O4��NO������壬��2.24L����״���£�O2��Ϻ�ͨ��ˮ��ǡ�ñ���ȫ�����������ᣮ��Ӧ�����ĵ�NaOH��Һ������ǣ� ��
A.150ml
B.180ml
C.200ml
D.250ml
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����MgCl2��AlCl3�����Һ������ʼ�μ�7 mL�Լ�A��֮��ĵμ��Լ�B�����ó������ʵ���y (mol) ���Լ����V(mL)��Ĺ�ϵ��ͼ��ʾ��(�Լ�A��B�ֱ���NaOH ��Һ�����е�һ��)
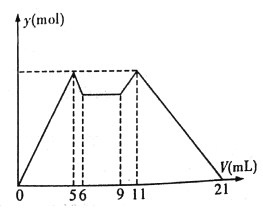
���½��۲���ȷ����
A. A��NaOH ��Һ��B������
B. ԭ���Һ����c(Al3+) :c(Mg2+) :c(Cl-)=1:1:5
C. c(NaOH) :c(HCl)=1:2
D. ��6 ��9 �Ĺ������������ķ�Ӧ�����ӷ�Ӧ����ʽ��H+ +OH-=H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڼ�����������Һ�������Һ���Լ���
A����ˮ B��Na2CO3��Һ C��FeCl2��Һ D������Cu(OH)2����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��������ᷴӦ��������NaOH��Ӧ����(����)
A. Na2CO3B. NaHSO4C. NaHCO3D. Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���赥�ʼ��仯����Ӧ�÷�Χ�ܹ㡣��ش���������:
��1���Ʊ���뵼����ϱ����ȵõ��ߴ��衣���ȼ���(SiHCl3)��ԭ���ǵ�ǰ�Ʊ��ߴ������Ҫ��������������ʾ��ͼ����:
![]()
��д����ʯӢɰ�ͽ�̿�ڸ������Ʊ��ֹ�Ļ�ѧ��Ӧ����ʽ:_____________��
�������Ʊ����̱����ϸ������ˮ������SiHCl3��ˮ���ҷ�Ӧ����H2SiO3��HCl����һ��������д����ƽ�Ļ�ѧ��Ӧ����ʽ: _____________��H2��ԭSiHCl3������������O2����������ĺ����______________��
��2�������йع���ϵ�˵����ȷ����_____________ (����ĸ����)��
A.������Ӳ�ȴ��۵�������������������մɺ����
B.ʯӢ����������ǿ�������ڼ���������������
C.����10�ŷɴ�����̫���ܵ�ذ�ɽ�����ת��Ϊ����������ת�����ϵ�����Ҳ������������оƬ
D.��ͨ�������ɴ��ʯ��ʯ��ʯӢɰ�Ƴɵ������۵�ܸ�
E.���������跴Ӧ���ʿɲ�������Ϊ��Һ�ⵥ����
F.�����Ʒ����Ҫ�ɷ��뽨������ɰ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�á�ʵ������ȡ����������Ũ����Ͷ������̷�Ӧ����������з�Ӧ��KClO3��6HCl��Ũ����KCl��3Cl2����3H2O���÷�Ӧ���ŵ��Ƿ�Ӧ���������ٶȿ졢������ȡ����������ѧ֪ʶ�ش��������⣺
��1��������Ӧ��____�����������÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ____��
��2��������ͨ����ɫʯ����Һ�У����Թ۲쵽�������ǣ�______________________��
��3��ʵ�������ƺ�2.0 mol��L-1��NaOH��Һ����Ҫ������Һ____mL������2.24 L��������״����ǡ����ȫ��Ӧ��
��4����֪Br2��ˮ��Һ��Ũ�Ȳ�ͬ�����ֳ�ɫ�����ɫ��NaBr��Һ�л���ͨ��Cl2ʱ�����Կ�����ɫ��Һ��Ϊ����ɫ����д����Ӧ�����ӷ���ʽ______________��
��5������490 mL 2.0 mol��L-1 NaOH��Һ��
������������������ƹ����������____��
������ʵ����Ҫ����������ƽ�������룩��ҩ�ס��ձ�����Ͳ������������ͷ�ιܡ�______��
����������Һ�Ĺ����У����в���������ɽ��ƫ�ߵ���____��
A������ʱ����
B������ƿ�����������������ˮ
C���ܽ������ձ�δϴ��
D��NaOH�ܽ��δ��ȴ������ʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס���������ϡ��Һ����ü�pH=a���ҵ�pH=a+1�������ƶ�����ȷ���ǣ� ��
A.���ʵ���Ũ��c���ף�=10c���ң�
B.������ˮ���������H+�����ʵ���Ũ�Ⱥ��ҵ����
C.�к͵����ʵ���Ũ�ȵ������NaOH��Һ��ס�����������V���ң���10V���ף�
D.���е�c��OH����Ϊ����c��OH������10��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com