
【题目】2:326.26.26 联合国将2011年定为“国际化学年”,主题是“化学,人类的生活,人类的未来”,以鼓励青年人热爱化学。学习化学应该明白“从生活中来,到生活中去”的道理。

请填空:
(1)成人每天应从食物中摄取的几种元素的质量分别为: Mg 300 mg、Ca 800 mg、Fe 14 mg、Cu 1.6 mg,这些元素的物质的量之比为_________。
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,计算出该注射液中葡萄糖的物质的量浓度为__________。
(3)SO2有毒,但葡萄酒里都含有微量SO2,起保鲜、杀菌和抗氧化作用,抗氧化作用利用了SO2的_______性。“硅胶”常用作实验室和袋装食品、瓶装药品等的干燥剂,也可以用作_______的载体。实验室可用________溶液来鉴别某未知液是苏打水还是水玻璃。
科目:高中化学 来源: 题型:
【题目】已知蛋白质含有C、H、O、N等元素。下列关于自然界中氮循环的说法错误的是
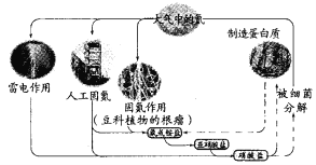
A. 含氮无机物和含氮有机物可相互转化
B. 碳、氢、氧三种元素也可能参与了氮循环
C. 铵盐转化为硝酸盐,发生了还原反应
D. 目前人工固氮的反应为N2+3H2![]() 2NH3
2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_______mol电子。
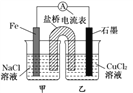
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式:_____________________,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是,“溶液中的十3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是_______________,电极反应为________________;乙装置中石墨(1)为_______(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为______________________。
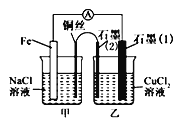
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH与水反应化学方程式为NaH+H2O=NaOH+H2↑.在该反应中H2O是( )
A.是氧化剂
B.是还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。
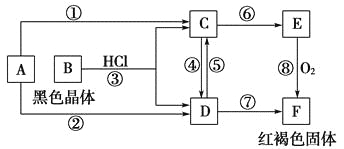
(1)确定A、B、C、D、E、F的化学式:
A为________,B为________,C为________。
D为________,E为________,F为________。
(2)写出⑧的化学方程式及④、⑤的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水既不做氧化剂又不做还原剂的是( )
A. CaO + H2O===Ca(OH)2 B. C+H2O(g)![]() CO+H2
CO+H2
C. 2F2 + 2H2O===4HF + O2 D. 2Na2O2 +2H2O===4NaOH + O2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求回答下列问题:
(1)某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol/L AgNO3溶液中加入2 mL 0.005 mol/L KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/L Fe(NO3)3溶液 | 溶液变为红色 |
步骤3:向步骤2的溶液中继续加入5滴3 mol/L AgNO3溶液 | 溶液浑浊、红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol/L KI溶液 | 出现黄色沉淀 |
① 步骤3实验目的是_____________________________。
② 用化学平衡原理解释步骤4中的实验现象:___________________________。
(2)已知:
NH4Cl(s) = NH3(g) + HCl(g) ΔH = +163.9 kJmol-1
HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g) ΔH = -31.9 kJmol-1
①写出氯化铵和甲醇反应的热化学方程式____________________________,该反应在一定条件下能自发进行的原因是___________________________。
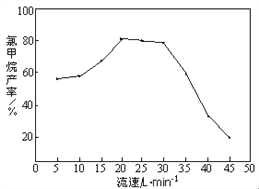
②由下图知,HCl和CH3OH的混合气体通过催化剂时的最佳流速在20 Lmin-1~30 Lmin-1之间。流速过快,会导致氯甲烷产率下降,原因是_________________________。流速过慢,会使副产物二甲醚增多,其反应为2CH3OH → CH3OCH3 + H2O,生产中常通入适量的水蒸气,该操作对制备CH3Cl的影响是___________________________。
(3)某高能锂离子电池充电时,总反应方程式为LiMn2O4=Li1-xMn2O4+xLi。则充电时阳极的电极反应方程式为______________________________________________。若电池的化学能转化为电能时的能量转化率为90%,则当消耗14 g锂时,电路中转移的电子数目为__________NA。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com