
【题目】NaH与水反应化学方程式为NaH+H2O=NaOH+H2↑.在该反应中H2O是( )
A.是氧化剂
B.是还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
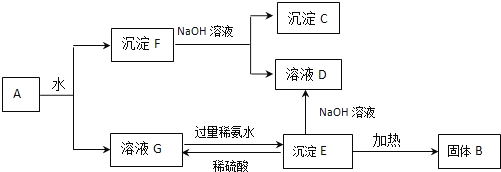
请回答下列问题。
(1)固体B____________、沉淀C____________(填化学式)。
(2)沉淀F与NaOH溶液反应的离子方程式为________________________________。
沉淀E与稀硫酸反应的离子方程式为____________________________________。
溶液G与过量稀氨水反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铬铁矿主要成分是FeO·Cr2O3,含有FeCO3、SiO2、Fe3O4等杂质,现由该铬铁矿制备强氧化剂Na2Cr2O7的流程如下:
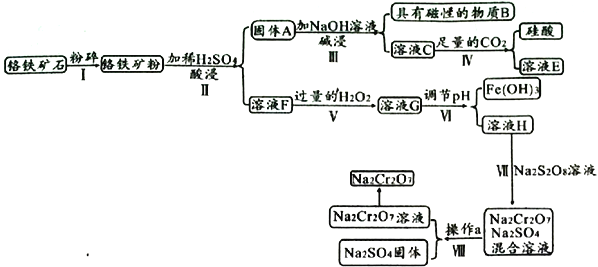
已知:常温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Cr(OH)3]=6.3×10-30
回答下列问题:
(1)物质B为______________,溶液E为____________________。
(2)溶液G中经检测不含H2O2的可能原因是________________________________________。
(3)若步骤Ⅵ调节pH后,c(Cr3+)=6.3mol/L,则pH范围是______________(离子浓度不大于1.0×10-5mol/L即可认为沉淀完全)。
(4)步骤Ⅶ发生的离子方程式为________________________________________。
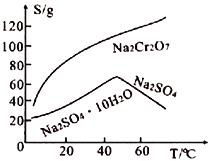
(5)Na2Cr2O7和Na2SO4的溶解度随温度变化的曲线如下图所示,步骤Ⅷ中操作a为___________、__________________。
(6)若称取mg该铬铁矿,其中FeO·Cr2O3的质量分数为70%,最终制得ng Na2Cr2O7固体,则该过程中Cr元素的转化率为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铝粉和Fe3O4粉末配成铝热剂并分成两等份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是
A. 3∶8 B. 8∶3
C. 3∶4 D. 4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用下图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
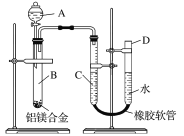
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是________________________________。
(3)将药品和水装入各仪器中,连接好装置后,需进行的操作还有①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是____________(填序号);记录C的液面位置时,除视线平视外,还应___________________________。
(4)B中发生反应的化学方程式为____________________________________________________。
(5)若实验用的铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将______(填“偏大”“偏小”或“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2:326.26.26 联合国将2011年定为“国际化学年”,主题是“化学,人类的生活,人类的未来”,以鼓励青年人热爱化学。学习化学应该明白“从生活中来,到生活中去”的道理。

请填空:
(1)成人每天应从食物中摄取的几种元素的质量分别为: Mg 300 mg、Ca 800 mg、Fe 14 mg、Cu 1.6 mg,这些元素的物质的量之比为_________。
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,计算出该注射液中葡萄糖的物质的量浓度为__________。
(3)SO2有毒,但葡萄酒里都含有微量SO2,起保鲜、杀菌和抗氧化作用,抗氧化作用利用了SO2的_______性。“硅胶”常用作实验室和袋装食品、瓶装药品等的干燥剂,也可以用作_______的载体。实验室可用________溶液来鉴别某未知液是苏打水还是水玻璃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,有下列反应发生: ①N2 + O2 = 2NO;②2NO+O2=2NO2;③3NO2 + H2O = 2HNO3 + NO;④ 2SO2+O2 = 2SO3;⑤ SO3 + H2O = H2SO4; ⑥SO2+H2O![]() H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
A. ①②③④ B. ①②③④⑦ C. ①②④⑦ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2HI+Cl2=2HCl+I2,②2Fe+3Cl2=2FeCl3,③2FeBr2+3Cl2=2FeCl3+2Br2.在一定条件下HI、Fe、FeBr2分别与足量的Cl2反应,如果三个反应电子转移数目相等,则HI、Fe、FeBr2的物质的量之比为
A. 1:1:1 B. 1:3:3 C. 3:1:1 D. 6:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com