
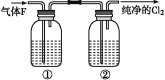
ΓΨΧβΡΩΓΩΈΣΝΥ÷Τ±Η¬»ΤχΘ§Ρ≥Ά§―ß≤ι‘ΡΉ ΝœΖΔœ÷ Β―ι “άο≥Θ”Ο≈®―ΈΥα”κΕΰ―θΜ·ΟΧΖ¥”Πά¥÷Τ»Γ…ΌΝΩΒΡ¬»ΤχΘ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚMnO2+4HClΘ®≈®Θ©![]() MnCl2+Cl2Γϋ+2H2O
MnCl2+Cl2Γϋ+2H2O
Θ®1Θ©«κ”ΟΥΪœΏ«≈Ζ®Ε‘ΗΟΖ¥”ΠΫχ––±ξΉΔ_________________________________ΓΘ
Θ®2Θ©–¥≥ωΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ________________ΓΘ
Θ®3Θ©ΗΟΆ§―ß”Ο43.5g MnO2”κΉψΝΩΒΡ HClΘ®≈®Θ©Ζ¥”ΠΘ§Ω…÷Τ±Η±ξΩωœ¬ΒΡ¬»ΤχΒΡΧεΜΐΈΣ_______ L,Ζ¥”Π÷–ΉΣ“ΤΒΡΒγΉ”ΒΡΈο÷ ΒΡΝΩΈΣ_______molΘ§Ζ¥”Π÷–±Μ―θΜ·ΒΡHClΈο÷ ΒΡΝΩΈΣ_______molΓΘ
Θ®4Θ©‘Ύ Β―ι “÷–,”ϊ”Ο»γΆΦ÷–ΒΡΉΑ÷ΟΨΜΜ·¬»Τχ,‘ρΤΩΔΌΔΎ÷–”Π ΔΖ≈ΒΡ ‘ΦΝΖ÷±π «ΔΌ____,ΔΎ_____Θ®Χν ‘ΦΝΟϊ≥Τ)ΓΘ
ΓΨ¥πΑΗΓΩ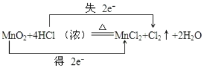 MnO2+4H++2Cl-
MnO2+4H++2Cl-![]() Mn2++Cl2Γϋ+2H2O 11.2 1 1 ±ΞΚΆ ≥―ΈΥ° ≈®ΝρΥα
Mn2++Cl2Γϋ+2H2O 11.2 1 1 ±ΞΚΆ ≥―ΈΥ° ≈®ΝρΥα
ΓΨΫβΈωΓΩ
(1)Ζ¥”ΠMnO2+4HClΘ®≈®Θ©![]() MnCl2+Cl2Γϋ+2H2O÷–Θ§Mn‘ΣΥΊΜ·ΚœΦέΫΒΒΆΘ§±ΜΜΙ‘≠Θ§MnO2ΈΣ―θΜ·ΦΝΘ§Cl‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘ§±Μ―θΜ·Θ§HClΈΣΜΙ‘≠ΦΝΘ§Cl2ΈΣ―θΜ·≤ζΈοΘ§MnCl2ΈΣΜΙ‘≠≤ζΈοΘ§”…‘ΣΥΊΜ·ΚœΦέ±δΜ·Ω…÷ΣΉΣ“ΤΒΡΒγΉ” ΐΡΩΈΣ2Θ§”ΟΥΪœΏ«≈Ζ®±μ Ψ―θΜ·ΜΙ‘≠Ζ¥”Π÷÷ΒγΉ”ΉΣ“Τ«ιΩωΈΣ
MnCl2+Cl2Γϋ+2H2O÷–Θ§Mn‘ΣΥΊΜ·ΚœΦέΫΒΒΆΘ§±ΜΜΙ‘≠Θ§MnO2ΈΣ―θΜ·ΦΝΘ§Cl‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘ§±Μ―θΜ·Θ§HClΈΣΜΙ‘≠ΦΝΘ§Cl2ΈΣ―θΜ·≤ζΈοΘ§MnCl2ΈΣΜΙ‘≠≤ζΈοΘ§”…‘ΣΥΊΜ·ΚœΦέ±δΜ·Ω…÷ΣΉΣ“ΤΒΡΒγΉ” ΐΡΩΈΣ2Θ§”ΟΥΪœΏ«≈Ζ®±μ Ψ―θΜ·ΜΙ‘≠Ζ¥”Π÷÷ΒγΉ”ΉΣ“Τ«ιΩωΈΣ Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ ΘΜ
ΘΜ
(2)Ζ¥”Π÷÷MnO2ΚΆH2OΈΣ―θΜ·ΈοΘ§Cl2ΈΣΒΞ÷ Θ§≤Μ≤πΘ§‘ράκΉ”ΖΫ≥Χ ΫΈΣMnO2+4H++2Cl-![]() Mn2++Cl2Γϋ+2H2OΘ§Ι ¥πΑΗΈΣΘΚMnO2+4H++2Cl-
Mn2++Cl2Γϋ+2H2OΘ§Ι ¥πΑΗΈΣΘΚMnO2+4H++2Cl-![]() Mn2++Cl2Γϋ+2H2OΘΜ
Mn2++Cl2Γϋ+2H2OΘΜ
(3)ΗυΨίΙΪ Ϋ![]() Ω…ΒΟΘ§43.5gMnO2ΒΡΈο÷ ΒΡΝΩΈΣ0.5molΘ§‘ΌΫαΚœΜ·―ßΖ¥”ΠΖΫ≥Χ ΫΘ§Έο÷ ΒΡΝΩ”κΜ·―ßΦΤΝΩ ΐ≥…’ΐ±»Θ§‘ρœϊΚΡ2molHClΘ§…ζ≥…0.5mol¬»ΤχΘ§±ξΩωœ¬ΧεΜΐΈΣ11.2LΘ§Ζ¥”Π÷–ΉΣ“ΤΒΡΒγΉ”ΒΡΈο÷ ΒΡΝΩ=0.5molΓΝ2=1molΘ§Τδ÷–2molHCl÷–”–1molHCl±Μ―θΜ·Θ§Ι ¥πΑΗΈΣΘΚ11.2ΘΜ1ΘΜ1ΘΜ
Ω…ΒΟΘ§43.5gMnO2ΒΡΈο÷ ΒΡΝΩΈΣ0.5molΘ§‘ΌΫαΚœΜ·―ßΖ¥”ΠΖΫ≥Χ ΫΘ§Έο÷ ΒΡΝΩ”κΜ·―ßΦΤΝΩ ΐ≥…’ΐ±»Θ§‘ρœϊΚΡ2molHClΘ§…ζ≥…0.5mol¬»ΤχΘ§±ξΩωœ¬ΧεΜΐΈΣ11.2LΘ§Ζ¥”Π÷–ΉΣ“ΤΒΡΒγΉ”ΒΡΈο÷ ΒΡΝΩ=0.5molΓΝ2=1molΘ§Τδ÷–2molHCl÷–”–1molHCl±Μ―θΜ·Θ§Ι ¥πΑΗΈΣΘΚ11.2ΘΜ1ΘΜ1ΘΜ
(4)≈®―ΈΥα”κMnO2Ζ¥”Π÷Τ»ΓCl2Θ§Ζ¥”Π–η“ΣΦ”»»Θ§HCl“ΉΜ”ΖΔΘ§Ά§ ±…ζ≥…Υ°Θ§–η“Σ”Ο±ΞΚΆ ≥―ΈΥ°ά¥≥ΐ»ΞΜ”ΖΔΒΡHClΘ§‘Ό”Ο≈®ΝρΥαΫχ––Η…‘οΘ§Ι ¥πΑΗΈΣΘΚ±ΞΚΆ ≥―ΈΥ°ΘΜ≈®ΝρΥαΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―«ΝρΥαΡΤ «÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΘ§≥Θ”ΟΉςΜΙ‘≠ΦΝΓΔΖάΗ·ΦΝΓΔ»Ξ¬»ΦΝΒ»ΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)“Σ≈δ÷Τ250mL0.5mol/LΒΡNa2SO3»ή“ΚΘ§–η“Σ”ΟΆ–≈ΧΧλΤΫ≥Τ»ΓNa2SO3ΓΛ7H2OΨßΧε________gΓΘ≈δ÷Τ»ή“ΚΥυ”ΟΒΫΒΡ≤ΘΝß“«Τς”–ΘΚ≤ΘΝßΑτΓΔ…’±≠ΓΔΝΩΆ≤ΚΆ_________________ΓΘ
(2)≈δ÷ΤΙΐ≥Χ÷–Υυ”Ο’τΝσΥ°–η÷σΖ–ΓΔά以Κσ≤≈Ρή Ι”ΟΘ§÷σΖ–’τΝσΥ°ΒΡΡΩΒΡ «________ΓΘ
(3)œ¬Ν–≤ΌΉςΜα ΙΥυ≈δ»ή“Κ≈®Ε»ΤΪΗΏΒΡ «________ΓΘ
A.Υυ―Γ”ΟΒΡ»ή÷ “―Ψ≠ ß»Ξ≤ΩΖ÷ΫαΨßΥ° B.―«ΝρΥαΡΤΨßΧε”κμά¬κΈΜ÷ΟΖ≈Ζ¥ΝΥ
C.ΉΣ“Τ»ή“Κ ±≤ΘΝßΑτΩΩ‘ΎΩΧΕ»œΏ…œΖΫ D.Ε®»ί ±Η© ”»ίΝΩΤΩΒΡΩΧΕ»œΏ
E.“Γ‘»Κσ»ή“ΚΒΆ”ΎΩΧΕ»œΏΘ§‘ΌΦ”»κ’τΝσΥ° Ι“ΚΟφΉνΒΆΒψ”κΩΧΕ»œΏœύ«–
(4)Na2SO3Ζ≈‘ΎΩ’Τχ÷–»ί“Ή±Μ―θΜ·±δ÷ ΓΘΦλ―ιNa2SO3»ή“Κ «Ζώ±δ÷ ΒΡΖΫΖ® «_______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“‘”–ΜζΈοAΈΣ‘≠ΝœΚœ≥…ΨέΚœΈοPMAΚΆΨέΧΦΥαθΞPCΒΡ¬ΖœΏ»γœ¬ΘΚ

ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)œ¬Ν–ΙΊ”ΎΗΏΖ÷Ή”Μ·ΚœΈοΒΡΥΒΖ®÷–’ΐ»ΖΒΡ «________ΓΘΘ®Χν±ξΚ≈Θ©
a.Ψέ““œ©Ζ÷Ή”÷–Κ§”–ΧΦΧΦΥΪΦϋ
b.![]() ΒΡΒΞΧε «2-ΕΓ»≤
ΒΡΒΞΧε «2-ΕΓ»≤
c.ΟόΜ®ΓΔ―ρΟΪΚΆ≤œΥΩ «Χλ»ΜœΥΈ§
d.CuSO4»ή“ΚΩ… ΙΒΑΑΉ÷ ±δ–‘
(2)AΒΡΜ·―ßΟϊ≥Τ «________Θ§C÷–ΒΡΙΌΡήΆ≈Οϊ≥ΤΈΣ_________ΓΘ
(3)ΔΌΒΡΖ¥”Πάύ–ΆΈΣ________Θ§ΔέΒΡΖ¥”Πάύ–ΆΈΣ________ΓΘ
(4)Ζ¥”ΠΔΎΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_____________________ΓΘ
(5)BΒΡΆ§œΒΈοC5H8O2Ι≤”–____________÷÷Ά§Ζ÷“λΙΙΧεΘ®≤ΜΚ§ΝΔΧε“λΙΙΘ©Θ§–¥≥ωΤδ÷–ΚΥ¥≈Ι≤’ώ«βΤΉΈΣ»ΐΉιΖεΒΡΈο÷ ΒΡΫαΙΙΦρ ΫΘΚ______________ΓΘ
(6)≤Έ’’…œ ωΚœ≥…¬ΖœΏΘ§“‘CH3CHOΈΣ‘≠Νœ(ΈόΜζ ‘ΦΝ»Έ―Γ)Θ§…ηΦΤ÷Τ±Η ΒΡΚœ≥…¬ΖœΏ________________ΓΘ
ΒΡΚœ≥…¬ΖœΏ________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΚΎ…Ϊ“±ΫπΙΛ“Β÷–≥ΐΝΥΧζΓΔΟΧΓΔΗθΓΔΖΑΓΔν―“‘ΦΑ’β–©Ϋπ τΒΡΚΎ…ΪΫπ τΚœΫπ“‘ΆβΘ§ΤδΥϊΒΡΫπ τΘ§ΕΦΥψ «”–…ΪΫπ τΓΘ
![]() ΜυΧ§ν―‘≠Ή”ΒΡΫαΙΙ Ψ“βΆΦΈΣ________ΘΜΜυΧ§Ηθ‘≠Ή”ΒΡΦέ≤ψΒγΉ”≈≈≤Φ ΫΈΣ________ΓΘ
ΜυΧ§ν―‘≠Ή”ΒΡΫαΙΙ Ψ“βΆΦΈΣ________ΘΜΜυΧ§Ηθ‘≠Ή”ΒΡΦέ≤ψΒγΉ”≈≈≤Φ ΫΈΣ________ΓΘ
![]() ÷–CΓΔNΒΡΒγΗΚ–‘ΙΊœΒΈΣC________
÷–CΓΔNΒΡΒγΗΚ–‘ΙΊœΒΈΣC________![]() ΧνΓΑ
ΧνΓΑ![]() Γ±ΜρΓΑ
Γ±ΜρΓΑ![]() Γ±
Γ±![]() ΘΜ
ΘΜ![]() ΒΡΖ–Βψ±»
ΒΡΖ–Βψ±»![]() ΒΡΖ–ΒψΒΆΘ§Τδ‘≠“ρ «________ΓΘ
ΒΡΖ–ΒψΒΆΘ§Τδ‘≠“ρ «________ΓΘ
![]() ÷–C‘≠Ή”ΒΡ‘”Μ·ΖΫ ΫΈΣ________ΘΜ
÷–C‘≠Ή”ΒΡ‘”Μ·ΖΫ ΫΈΣ________ΘΜ![]() Ζ÷Ή” «________
Ζ÷Ή” «________![]() ΧνΓΑΦΪ–‘Γ±ΜρΓΑΖ«ΦΪ–‘Γ±
ΧνΓΑΦΪ–‘Γ±ΜρΓΑΖ«ΦΪ–‘Γ±![]() Ζ÷Ή”ΘΜ
Ζ÷Ή”ΘΜ![]() Ζ÷Ή”÷–
Ζ÷Ή”÷–![]() Φϋ”κ
Φϋ”κ![]() ΦϋΒΡ ΐΡΩ÷°±»ΈΣ________ΓΘ
ΦϋΒΡ ΐΡΩ÷°±»ΈΣ________ΓΘ
![]() Ϋπ τΟΧΒΡ“Μ÷÷ΨßΧεΈΣΟφ–ΡΝΔΖΫΉνΟήΕ―ΜΐΘ§ΤδΨßΑϊ÷–”–________ΗωΟΧ‘≠Ή”Θ§ΟΩΗωΟΧ‘≠Ή”÷ήΈßΫτΝΎΒΡΟΧ‘≠Ή””–________ΗωΓΘ
Ϋπ τΟΧΒΡ“Μ÷÷ΨßΧεΈΣΟφ–ΡΝΔΖΫΉνΟήΕ―ΜΐΘ§ΤδΨßΑϊ÷–”–________ΗωΟΧ‘≠Ή”Θ§ΟΩΗωΟΧ‘≠Ή”÷ήΈßΫτΝΎΒΡΟΧ‘≠Ή””–________ΗωΓΘ
![]() “ρ
“ρ![]() ΚΆ
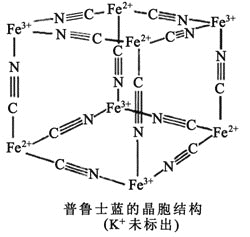
ΚΆ![]() ΆβΈß”–ΫœΕύΡήΝΩœύΫϋΒΡΩ’ΙλΒάΘ§Ι Ρή”κ“Μ–©Ζ÷Ή”ΜράκΉ”–Έ≥…≈δΚœΈοΓΘ»γΆΦΈΣΤ’¬≥ ΩάΕ≈δΚœΈοΨßΧεΫαΙΙΒΡ Ψ“βΆΦ
ΆβΈß”–ΫœΕύΡήΝΩœύΫϋΒΡΩ’ΙλΒάΘ§Ι Ρή”κ“Μ–©Ζ÷Ή”ΜράκΉ”–Έ≥…≈δΚœΈοΓΘ»γΆΦΈΣΤ’¬≥ ΩάΕ≈δΚœΈοΨßΧεΫαΙΙΒΡ Ψ“βΆΦ![]() ΟΩΝΫΗωΝΔΖΫΧε÷–Θ§“ΜΗω
ΟΩΝΫΗωΝΔΖΫΧε÷–Θ§“ΜΗω![]() ‘ΎΤδ÷–“ΜΗωΝΔΖΫΧε÷––ΡΘ§Νμ“ΜΗω‘ρΈό
‘ΎΤδ÷–“ΜΗωΝΔΖΫΧε÷––ΡΘ§Νμ“ΜΗω‘ρΈό![]() Θ§ΤδΜ·―ß Ϋ «________ΓΘ
Θ§ΤδΜ·―ß Ϋ «________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ![]() Ζ÷±π±μ Ψ÷–―ßΜ·―ß÷–≥ΘΦϊΒΡ“Μ÷÷Έο÷ Θ§ΥϋΟ«÷°ΦδΒΡœύΜΞΙΊœΒ»γΆΦΥυ Ψ
Ζ÷±π±μ Ψ÷–―ßΜ·―ß÷–≥ΘΦϊΒΡ“Μ÷÷Έο÷ Θ§ΥϋΟ«÷°ΦδΒΡœύΜΞΙΊœΒ»γΆΦΥυ Ψ![]() ≤ΩΖ÷Ζ¥”ΠΈοΓΔ…ζ≥…ΈοΟΜ”–Ν–≥ω
≤ΩΖ÷Ζ¥”ΠΈοΓΔ…ζ≥…ΈοΟΜ”–Ν–≥ω![]() Θ§«“AΓΔBΓΔCΓΔDΓΔEΓΔFΝυ÷÷Έο÷ ÷–ΨυΚ§Ά§“Μ÷÷‘ΣΥΊΘ°
Θ§«“AΓΔBΓΔCΓΔDΓΔEΓΔFΝυ÷÷Έο÷ ÷–ΨυΚ§Ά§“Μ÷÷‘ΣΥΊΘ°
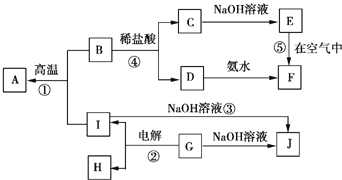
«κΧν–¥œ¬Ν–Ω’ΑΉΘΚ
![]() ΓΔBΓΔCΓΔDΓΔEΓΔFΝυ÷÷Έο÷ ÷–ΥυΚ§ΒΡΆ§“Μ÷÷‘ΣΥΊ‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷ΟΈΣ ______ Θ°
ΓΔBΓΔCΓΔDΓΔEΓΔFΝυ÷÷Έο÷ ÷–ΥυΚ§ΒΡΆ§“Μ÷÷‘ΣΥΊ‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷ΟΈΣ ______ Θ°
![]() Ζ¥”Π
Ζ¥”Π![]() ―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ ______ Θ§Ζ¥”Π
―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ ______ Θ§Ζ¥”Π![]() ΒΡάκΉ”ΖΫ≥Χ ΫΈΣ ______ Θ§Ζ¥”Π
ΒΡάκΉ”ΖΫ≥Χ ΫΈΣ ______ Θ§Ζ¥”Π![]() ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ ______ Θ°
ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ ______ Θ°
![]() Β―ι “≈δ÷ΤC»ή“Κ ±Ά®≥Θ“ΣΦ”»κ…ΌΝΩΒΡ ______ ΘΜΫΪ…ΌΝΩDΒΡ≈®»ή“ΚΒΈ»κΖ–Υ°÷–ΒΟΒΫΒΡ“ΚΧε≥ ______ …ΪΘ§‘Ό÷πΒΈΒΈΦ”―ΈΥα ±Θ§≤ζ…ζΒΡœ÷œσ « ______ ΘΜ
Β―ι “≈δ÷ΤC»ή“Κ ±Ά®≥Θ“ΣΦ”»κ…ΌΝΩΒΡ ______ ΘΜΫΪ…ΌΝΩDΒΡ≈®»ή“ΚΒΈ»κΖ–Υ°÷–ΒΟΒΫΒΡ“ΚΧε≥ ______ …ΪΘ§‘Ό÷πΒΈΒΈΦ”―ΈΥα ±Θ§≤ζ…ζΒΡœ÷œσ « ______ ΘΜ
![]() Ζ¥”Π
Ζ¥”Π![]() ÷–ΟΩ…ζ≥…3molAΘ§ΉΣ“ΤΒγΉ”ΒΡΈο÷ ΒΡΝΩΈΣ ______ Θ°
÷–ΟΩ…ζ≥…3molAΘ§ΉΣ“ΤΒγΉ”ΒΡΈο÷ ΒΡΝΩΈΣ ______ Θ°
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΕΨ÷Ί ·ΒΡ÷ς“Σ≥…Ζ÷BaCO3Θ®Κ§Ca2+ΓΔMg2+ΓΔFe3+Β»‘”÷ Θ©Θ§ Β―ι “άϊ”ΟΕΨ÷Ί ·÷Τ±ΗBaCl22H2OΒΡΝς≥Χ»γœ¬ΘΚ

Θ®1Θ©ΕΨ÷Ί ·”Ο―ΈΥαΫΰ»Γ«Α–η≥δΖ÷―–ΡΞΘ§ΡΩΒΡ «____________________ΓΘ Β―ι “”Ο37%ΒΡ―ΈΥα≈δ÷Τ15%ΒΡ―ΈΥαΘ§≥ΐΝΩΆ≤ΆβΜΙ–η Ι”Οœ¬Ν–“«Τς÷–ΒΡ______________ΓΘ
aΘ°…’±≠ bΘ°»ίΝΩΤΩ cΘ°≤ΘΝßΑτ dΘ°ΒΈΕ®Ιή
Θ®2Θ©Φ”»κNH3H2OΒςΫΎpH=8Ω…≥ΐ»Ξ_____Θ®ΧνάκΉ”ΖϊΚ≈Θ©Θ§¬Υ‘ϋΔρ÷–Κ§______Θ®ΧνΜ·―ß ΫΘ©ΓΘΦ”»κH2C2O4 ±”Π±ήΟβΙΐΝΩΘ§‘≠“ρ «_________________ΓΘ
“―÷ΣΘΚKspΘ®BaC2O4Θ©=1.6ΓΝ10©¹7Θ§KspΘ®CaC2O4Θ©=2.3ΓΝ10©¹9
Ca2+ | Mg2+ | Fe3+ | |
ΩΣ Φ≥ΝΒμ ±ΒΡpH | 11.9 | 9.1 | 1.9 |
Άξ»Ϊ≥ΝΒμ ±ΒΡpH | 13.9 | 11.1 | 3.2 |
Θ®3Θ©άϊ”ΟΦδΫ”ΥαΦνΒΈΕ®Ζ®Ω…≤βΕ®Ba2+ΒΡΚ§ΝΩΘ§ Β―ιΖ÷ΝΫ≤ΫΫχ––ΓΘ
“―÷ΣΘΚ2CrO42©¹+2H+®TCr2O72©¹+H2O Ba2++CrO42©¹®TBaCrO4Γΐ
≤Ϋ÷ηΔώΘΚ“Τ»Γx ml“ΜΕ®≈®Ε»ΒΡNa2CrO4»ή“Κ”ΎΉΕ–ΈΤΩ÷–Θ§Φ”»κΥαΦν÷Η ΨΦΝΘ§”Οb molL©¹1―ΈΥα±ξΉΦ“ΚΒΈΕ®÷Ν÷’ΒψΘ§≤βΒΟΒΈΦ”ΒΡ―ΈΥαΧεΜΐΈΣV0 mLΓΘ
≤Ϋ÷ηΔρΘΚ“Τ»Γy mLBaCl2»ή“Κ”ΎΉΕ–ΈΤΩ÷–Θ§Φ”»κx mL”κ≤Ϋ÷ηΔώœύΆ§≈®Ε»ΒΡNa2CrO4»ή“ΚΘ§¥ΐBa2+Άξ»Ϊ≥ΝΒμΚσΘ§‘ΌΦ”»κΥαΦν÷Η ΨΦΝΘ§”Οb molL©¹1―ΈΥα±ξΉΦ“ΚΒΈΕ®÷Ν÷’ΒψΘ§≤βΒΟΒΈΦ”―ΈΥαΒΡΧεΜΐΈΣV1 mLΓΘ
ΒΈΦ”―ΈΥα±ξΉΦ“Κ ±”Π Ι”ΟΥα ΫΒΈΕ®ΙήΘ§ΓΑ0Γ±ΩΧΕ»ΈΜ”ΎΒΈΕ®ΙήΒΡ______________Θ®ΧνΓΑ…œΖΫΓ±ΜρΓΑœ¬ΖΫΓ±Θ©ΓΘBaCl2»ή“ΚΒΡ≈®Ε»ΈΣ______________ molL-1Θ§»τ≤Ϋ÷ηΔρ÷–ΒΈΦ”―ΈΥα ±”–…ΌΝΩ¥ΐ≤β“ΚΫΠ≥ωΘ§Ba2+≈®Ε»≤βΝΩ÷ΒΫΪ______________Θ®ΧνΓΑΤΪ¥σΓ±ΜρΓΑΤΪ–ΓΓ±Θ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗυΨίœ¬Ν–ΆΦ ΨΥυΒΟ≥ωΒΡΫα¬έ’ΐ»ΖΒΡ «
A.ΆΦΦΉ±μ ΨΖ¥”Π![]() ΒΡΤΫΚβ≥Θ ΐK”κΈ¬Ε»ΒΡΙΊœΒΘ§ΥΒΟςΗΟΖ¥”ΠΒΡ
ΒΡΤΫΚβ≥Θ ΐK”κΈ¬Ε»ΒΡΙΊœΒΘ§ΥΒΟςΗΟΖ¥”ΠΒΡ![]()
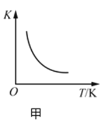
B.ΆΦ““±μ ΨCu”κΙΐΝΩ≈®œθΥαΖ¥”Π…ζ≥…ΒΡ![]() ΤχΧεΧεΜΐΥφ ±ΦδΒΡ±δΜ·ΙΊœΒΘ§ΥΒΟςΗΟΖ¥”Π‘Ύ
ΤχΧεΧεΜΐΥφ ±ΦδΒΡ±δΜ·ΙΊœΒΘ§ΥΒΟςΗΟΖ¥”Π‘Ύ![]() ±ΦδΕΈΡΎΖ¥”ΠΥΌ¬ ΉνΩλ
±ΦδΕΈΡΎΖ¥”ΠΥΌ¬ ΉνΩλ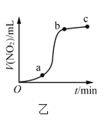
C.ΆΦ±ϊ±μ Ψ“ΜΕ®Έ¬Ε»œ¬![]() ΚΆNiSΒΡ≥ΝΒμ»ήΫβΤΫΚβ«ζœΏΘ§ΥΒΟςΗΟΈ¬Ε»œ¬Θ§
ΚΆNiSΒΡ≥ΝΒμ»ήΫβΤΫΚβ«ζœΏΘ§ΥΒΟςΗΟΈ¬Ε»œ¬Θ§![]() ±Θ§ΝΫ’ΏΒΡ
±Θ§ΝΫ’ΏΒΡ![]() œύΒ»
œύΒ»
D.ΆΦΕΓ±μ ΨœύΆ§Έ¬Ε»œ¬Θ§![]() ΒΡHFΚΆ
ΒΡHFΚΆ![]() »ή“ΚΖ÷±πΦ”Υ°œΓ Ά ±pHΒΡ±δΜ·«ζœΏΘ§ΥΒΟςΦ”Υ°œΓ Ά«ΑHFΒΡΒγάκ≥ΧΕ»¥σ”Ύ
»ή“ΚΖ÷±πΦ”Υ°œΓ Ά ±pHΒΡ±δΜ·«ζœΏΘ§ΥΒΟςΦ”Υ°œΓ Ά«ΑHFΒΡΒγάκ≥ΧΕ»¥σ”Ύ![]() ΒΡΒγάκ≥ΧΕ»
ΒΡΒγάκ≥ΧΕ»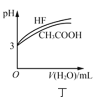
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥–Υ»Λ–ΓΉιΫχ––œ¬Ν– Β―ιΘΚ
ΔΌΫΪ0.1molΓΛL-1MgCl2»ή“ΚΚΆ0.5molΓΛL-1NaOH»ή“ΚΒ»ΧεΜΐΜλΚœΒΟΒΫΉ«“Κ
ΔΎ»Γ…ΌΝΩΔΌ÷–Ή«“ΚΘ§ΒΈΦ”0.1molΓΛL-1FeCl3»ή“ΚΘ§≥ωœ÷ΚλΚ÷…Ϊ≥ΝΒμ
ΔέΫΪΔΌ÷–Ή«“ΚΙΐ¬ΥΘ§»Γ…ΌΝΩΑΉ…Ϊ≥ΝΒμΘ§ΒΈΦ”0.1molΓΛL-1FeCl3»ή“ΚΘ§ΑΉ…Ϊ≥ΝΒμ±δΈΣΚλΚ÷…Ϊ≥ΝΒμ
ΔήΝμ»Γ…ΌΝΩΑΉ…Ϊ≥ΝΒμΘ§ΒΈΦ”±ΞΚΆNH4Cl»ή“ΚΘ§≥ΝΒμ»ήΫβ
œ¬Ν–ΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A.ΫΪΔΌ÷–ΥυΒΟΉ«“ΚΙΐ¬ΥΘ§ΥυΒΟ¬Υ“Κ÷–Κ§…ΌΝΩMg2+
B.ΔΌ÷–Ή«“Κ÷–¥φ‘Ύ≥ΝΒμ»ήΫβΤΫΚβΘΚMg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C. Β―ιΔΎΚΆΔέΨυΡήΥΒΟςFe(OH)3±»Mg(OH)2Ρ―»ή
D.NH4Cl»ή“Κ÷–ΒΡNH![]() Ω…Ρή «Δή÷–≥ΝΒμ»ήΫβΒΡ‘≠“ρ
Ω…Ρή «Δή÷–≥ΝΒμ»ήΫβΒΡ‘≠“ρ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·―ßΝ¥»Φ…’ΦΦ θ «ΡΩ«ΑΡή‘¥Νλ”ρ―–ΨΩΒΡ»»Βψ÷°“ΜΘ§”ΟNiOΉς‘Ί―θΧεΒΡΜ·―ßΝ¥»Φ…’ Ψ“βΆΦΚΆœύΙΊ»»Μ·―ßΖ¥”Π»γœ¬ΘΚ
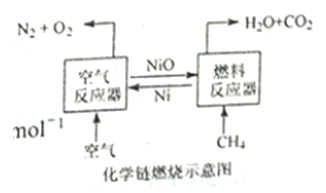
2Ni(s)+O2(g)=2NiO(s)ΓςH=-479.8 kJΓΛmol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)ΓςH=akJΓΛmol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)ΓςH=b kJΓΛmol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)ΓςH=156.9 kJΓΛmol-1
œ¬Ν–ΥΒΖ®¥μΈσΒΡ «Θ® Θ©
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) ΓςH=(2a-b) kJΓΛmol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΓςH=-802.7 kJΓΛmol-1
C. ΦΉΆι‘ΎΓΑ»ΦΝœΖ¥”ΠΤςΓ±÷–Ζ¥”Π ±≤ζ…ζΒ≠άΕ…ΪΜπ―φ≤ΔΖ≈≥ω»»ΝΩ
D. Κ§ΧΦ»ΦΝœάϊ”ΟΓΑΜ·―ßΝ¥»Φ…’ΦΦ θΓ±”–άϊ”ΎΕΰ―θΜ·ΧΦΒΡΖ÷άκ”κΜΊ ’
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com