
| 1 |
| 4 |
 ;
; ;平面正方型;
;平面正方型;| 1 |
| 4 |


科目:高中化学 来源: 题型:
| A、用淀粉溶液鉴别NaBr、KI溶液 |
| B、用KMnO4酸性溶液鉴别CH4、C2H4气体 |
| C、用AgNO3溶液鉴别Na2SO4、NaCl溶液 |
| D、用澄清石灰水鉴别Na2CO3、NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海带中提取碘单质的过程不涉及氧化还原反应 |
| B、往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 |
| C、赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 |
| D、虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度很低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
. |
| M |
A、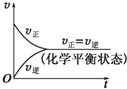 |
B、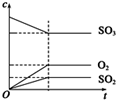 |
C、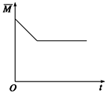 |
D、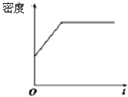 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1:c2=1:3 |
| B、N2、H2的转化率不相等 |
| C、平衡时,H2和NH3的生成速率之比为3:2 |
| D、c1的取值范围为0<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 4 |
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的弱酸HA与其钾盐KA的混合溶液中:2c(K+)=c(HA)+c(A-) |
| B、pH相同的CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液:c(K+)>c(Na+)>c(Ba2+) |
| C、氨水中逐滴加入盐酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=3的一元酸HA溶液和pH=11的一元碱MOH溶液等体积混合:c(M+)=c(A-)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com