
用吸附了氢气的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
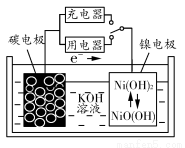
A.放电时,负极的电极反应式为H2-2e-+2OH-=2H2O
B.充电时,阳极的电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g) 2HBr(g) ΔH<0。当温度分别为T1,T2,平衡时,H2的体积分数与Br2(g)的物质的量的变化关系如图所示。下列说法不正确的是 ( )
2HBr(g) ΔH<0。当温度分别为T1,T2,平衡时,H2的体积分数与Br2(g)的物质的量的变化关系如图所示。下列说法不正确的是 ( )
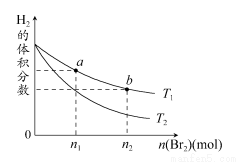
A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:填空题
如图所示,用石墨电极电解氯化铜溶液。查阅资料可知,CuCl42—显黄色,氯化铜溶液显蓝绿色或黄绿色;向体积相同浓度分别为0.01 mol/L、0.05 mol/L、0.1 mol/L、0.5 mol/L的氯化铜溶液中加入NaCl至饱和,对比发现,溶液的颜色由黄绿色向蓝绿色转变。
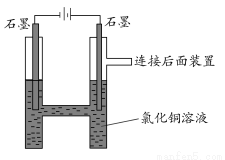
请回答下列问题:
(1)阳极上的气体呈________色,检验该气体可用________________。
(2)写出电解的离子方程式:________________。
(3)实验时,装置中阴极溶液颜色由蓝绿色变为黄绿色,原因是________。
(4)取出阴极的石墨棒,发现表面有浅蓝色固体,试设计实验探究此浅蓝色固体的成分:
____________________________________________________。
(5)为什么要设计连接后面的装置?
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:填空题
根据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示,其中盐桥为琼胶?饱和KNO3盐桥。请回答下列问题。( )
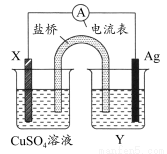
(1)电极X的材料是________,电解质溶液Y是________。
(2)银电极为电池的________极,写出两电极的电极反应式:
银电极:_________________________________________________;
X电极:___________________________________________________。
(3)外电路中,电子是从________电极流向________电极。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池。下列判断不正确的是( )
Fe2++Ag+设计成如图所示的原电池。下列判断不正确的是( )
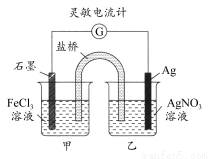
A.反应开始时,石墨棒作阳极,银棒作阴极
B.灵敏电流计的读数由小变大,再变小
C.反应达化学平衡时,电流计读数最小
D.反应达化学平衡时,在乙烧杯中滴入一定量的NaCl溶液,电流计指针又将偏转
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:填空题
(1)宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,试写出电解质溶液若为盐酸时的正极反应式:______________。
(2)已知4 g甲烷气体充分燃烧生成CO2(g)和H2O(l)时,放出Q kJ的热量。写出表示甲烷燃烧热的热化学方程式:______________________。
(3)已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-Q1 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-Q2 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=-Q3 kJ/mol
利用盖斯定律计算:FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变ΔH=________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
参照反应Br+H2 HBr+H的能量对反应历程的示意图。下列叙述正确的是( )
HBr+H的能量对反应历程的示意图。下列叙述正确的是( )
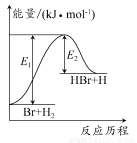
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,下列说法正确的是( )
A.X的最高价氧化物对应的水化物显弱酸性
B.Y的氧化物是离子化合物
C.X的氢化物的水溶液在空气中存放不易变质
D.X的氢化物和Z的氢化物反应生成一种对热稳定的化合物
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:选择题
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
A.Na2O2在上述反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.Na2FeO4处理水时,既能杀菌,又能产生胶体净水
D.2 mol FeSO4发生反应时,共有10 mol电子发生转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com