
参照反应Br+H2 HBr+H的能量对反应历程的示意图。下列叙述正确的是( )
HBr+H的能量对反应历程的示意图。下列叙述正确的是( )
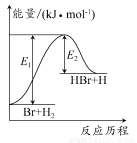
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
1 mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+aY(g) bZ(g)
bZ(g)
反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
A.a=1,b=1 B.a=2,b=1
C.a=2,b=2 D.a=3,b=3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:选择题
利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是 ( )

A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
用吸附了氢气的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
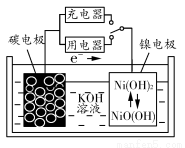
A.放电时,负极的电极反应式为H2-2e-+2OH-=2H2O
B.充电时,阳极的电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
A.-488.3 kJ/mol B.+488.3 kJ/mol
C.-191 kJ/mol D.+191 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:填空题
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示:
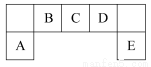
(1)B、C、D元素电负性的大小顺序为: > > (填元素符号)。
(2)E的氢化物与其最高价氧化物对应的水化物的钾盐共热能发生反应生成一种气体单质,反应的化学方程式为 。
(3)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L甲气体与0.5 L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是 。
(4)在298 K下,A、B的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来,若此置换反应生成3 mol B的单质,则该反应在298 K下的ΔH= 。(注:题中所设单质均为最稳定单质)
(5)要证明与D同主族相邻元素F的非金属性与E的非金属性的强弱,正确、合理的实验操作及现象是 。
(6)用A、B的单质作电极,C的最高价氧化物对应水化物的浓溶液作电解质溶液构成原电池,写出此原电池正极的电极反应式 。(假设C只被还原至+4价)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
五种短周期金属元素在元素周期表中的相对位置如图所示,下列判断正确的是( )
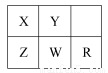
A.原子半径:Z<W<R
B.金属性:X>Z
C.氢氧化物的碱性:Z>W>R
D.最外层电子数:X>Y
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
以下说法中,不违背科学规律的是( )
①改变核外电子数可使原子与离子相互转化 ②改变核内中子数可使不同的同位素相互转化 ③改变核内质子数可使不同的元素相互转化,属于化学变化 ④改变离子的电荷数可使一种元素的阳离子转化为另一种元素的阴离子
A.①② B.②③ C.③④ D.①③
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:填空题
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
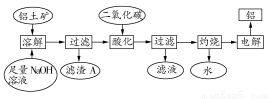
已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式: 。
(2)滤渣A的主要成分为 ;滤渣A的用途是 (只写一种);实验室过滤时使用玻璃棒,其作用是 。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是 。
(4)若将铝溶解,下列试剂中最好选用 (填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com