
【题目】丁达尔效应在日常生活中随处可见,下列情况下不能观察到丁达尔效应的是( )
A.光线透过树叶间的缝隙射入密林中
B.雾天时,打开汽车雾灯
C.日光从窗隙射入暗室
D.用激光笔照射玻璃杯中的蔗糖水
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2 ![]() CO+H2O的平衡常数表达式为K==
CO+H2O的平衡常数表达式为K==![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)===2CO2(g) ΔH2
2H2(g)+O2(g)===2H2O(g) ΔH3
则反应CO(g)+2H2(g)===CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。

③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不再发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g) ![]() CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。

0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g)
CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g) ![]() CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1993年8月,国际原子量委员会确认我国张青莲教授测定的锑的相对原子质量(121.760)为标准原子量,已知锑有两种以上天然同位素,则121.760是( )
A.锑元素的质量与12C原子质量1/12的比值
B.一个锑原子的质量与12C原子质量1/12的比值
C.按各种锑的天然同位素的相对原子质量与这些同位素所占的一定百分比计算出的平均值
D.按各种锑的天然同位素质量数与这些同位素所占的一定百分比计算出的平均值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八十年代,我国化学家打破了西方国家对维生素C的垄断,发明的“两段发酵法”大大降低了生产成本。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:

下列说法正确的是
A. 上述反应为取代反应
B. 维生素C水解得到2种产物
C. 维生素C有酯基不能溶于水,可溶于有机溶剂
D. 该反应表明维生素C具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是( )
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
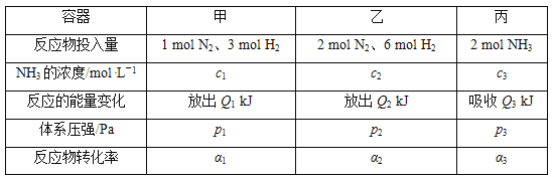
A. 2p1=2p3<p2
B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1
D. Q1+Q3=92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真分析物质的量浓度的概念及其定义式并思考,下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A. 将40gNaOH溶解于1L水中
B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将1L10 mol·L-1的浓盐酸与9L水混合
D. 将10gNaOH溶解于水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室进行下列实验, 括号内的实验用品都能用到的是
A. 苯的溴代(苯、溴水、试管)B. 蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液)
C. 钠的焰色反应(铂丝、氯化钠溶液、稀盐酸)D. 肥皂的制取(烧杯、玻璃棒、甘油)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小
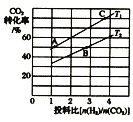
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com