
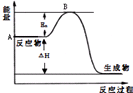
 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:分析 (1)A为反应物的总能量;1mol SO2(g)完全转化为1mol SO3(g)放热99kJ,根据参加反应SO2的物质的量之比等于对应的△H之比可计算a值;
(2)物质的活化能的大小与反应热无关;
(3)在101kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,以此书写热化学方程式;单质硫的燃烧热以及1mol SO2(g)氧化为1mol SO3的反应热利用盖斯定律来计算该题.
解答 解:(1)因图中A表示反应物总能量;因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,
故答案为:反应物总能量;-198;
(2)反应热为反应物总能量与生成物总能量之差,与活化能的大小无关,故答案为:无;
(3)因燃烧热概念要求必须是lmol物质完全燃烧,则热化学方程式为:S(s)+O2=SO2(g)△H=-296kJ•mol-1;因单质硫的燃烧热为296KJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296KJ•mol-1,而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,
则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
由盖斯定律可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-296KJ•mol-1+(-99kJ•mol-1)=-395KJ•mol-1,
所以S(s)生成4molSO3(g)的热量为395KJ•mol-1×4mol=1580 KJ,
故答案为:S(s)+O2=SO2(g)△H=-296kJ•mol-1;1580.
点评 本题主要考查了反应过程的能量变化图以及运用盖斯定律进行反应热的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,本题注意把握盖斯定律的运用,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
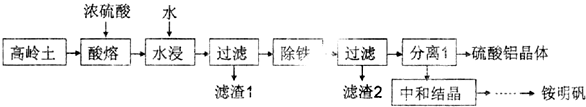
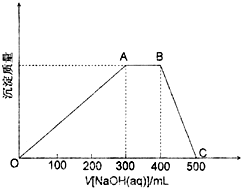
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
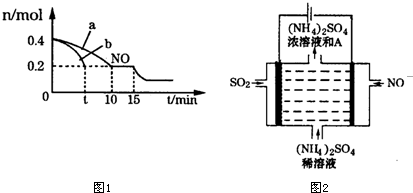
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
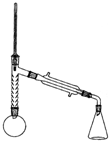
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
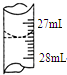 欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
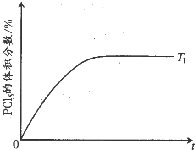
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com