
【题目】为减少酸雨的产生可采取的措施是
A. 用煤作燃料 B. 把工厂的烟囱造高
C. 化石燃料脱硫 D. 在已酸化的土壤中加石灰
科目:高中化学 来源: 题型:
【题目】下列关于浓HNO3与浓H2SO4的叙述正确的是( )
A.常温下遇铁都发生钝化
B.常温下都能与铜反应产生氢气
C.露置于空气中,溶液质量均不变
D.露置于空气中,溶液浓度均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铁片与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率,可以使用如下方法中的(选填序号). ①加20mL蒸馏水 ②升高温度(不考虑盐酸挥发)③加NaCl溶液 ④滴入几滴硫酸铜溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标1】乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应 ① 2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应 ② 2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1KJ·mol-1
乙醇异构化反应 ③ CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
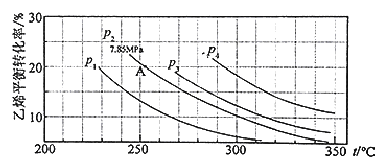
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 18g重水(D2O)所含的电子数为10NA
B. 常温常压下,0.3molNO2完全与水反应,转移的电子数为0.2NA
C. 标准状况下,22.4LCCl4中含有NA个CCl4分子
D. 常温下, 1L0.1mol/LCH3COONH4溶液中NH4+离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下一系列反应,最终产物为乙二酸。

试回答下列问题:
(1)C的结构简式是______________。
B→C的反应类型是________________,
E→F的化学方程式是___________________。
(2)E与乙二酸发生酯化反应生成环状化合物的化学方程式是__________________。
(3)由B发生水解反应或C与H2O发生加成反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下,下列说法错误的是
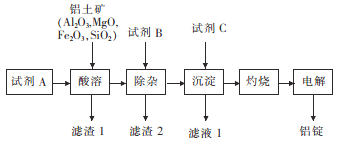
已知:滤渣2主要成分是氢氧化铁、氢氧化镁,B的焰色呈黄色。
A. 试剂A可以是稀硫酸或盐酸 B. 加入试剂B除去Mg2+、Fe3+
C. 滤渣1主要成分是SiO2 D. 电解氧化铝时在阴极上定期补炭块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物0.1摩和标准状况下的氧气5.6升恰好反应完全,所得产物为CO2、CO、H2O(气),产物通过盛浓硫酸的洗气瓶,洗气瓶的质量增加了5.4克,再通过足量灼热的氧化铜,氧化铜的质量减轻了1.6克,再通过装有碱石灰的干燥管,干燥管增加了8.8克。
(1)求有机物的分子式,
(2)若此有机物能与钠反应,写出其结构简式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com