
【题目】下列关于浓HNO3与浓H2SO4的叙述正确的是( )
A.常温下遇铁都发生钝化
B.常温下都能与铜反应产生氢气
C.露置于空气中,溶液质量均不变
D.露置于空气中,溶液浓度均不变
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】镁及其化合物有广泛用途.工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下
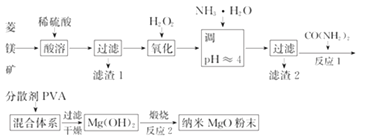
回答下列问题:
(1)滤渣1为____________(填化学式),CO(NH2)2的电子式为______。
(2)在实验室煅烧滤渣2制得的金属氧化物为______(填化学式),需要的仪器除酒精灯、三脚架以外,还需要______(填名称)。
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为__________。
(4)室温时,加入CO(NH2)2,产生沉淀。当 Mg2+沉淀完全时,溶液中的c(OH-)=_______(离子浓度小于1.0×10-5molL-1时,即可认为该离子沉淀完全;室温时,Ksp[Mg(OH)2]=1.96×10-11)
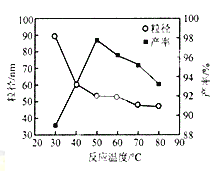
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制务纳米MgO。如图为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【河北省定州中学2017届高三下学期开学考试】将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)= 1 mol·L-1·min-1。则三个容器中合成氨的反应速率( )
A. v(甲)>v(乙)>v(丙)
B. v(乙)>v(丙)>v(甲)
C. v(丙)>v(甲)>v(乙)
D. v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质A经下列变化过程转化为D,其中C比B的相对分子质量多16,
![]()
已知D为强酸或者强碱,请回答下列问题:
(1)若常温下C为淡黄色固体,D的焰色为黄色,则工业制取D的反应方程式为:_______________;
(2)若A常温下是气体,C为红棕色气体。
①若A→B是工业制取硝酸的重要步骤之一,写出该步反应的化学方程式
为:_____________________________;
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的离子方程式
为:_________________________________________;
(3)若A为淡黄色固体,B是形成酸雨的罪魁祸首之一。
①D的化学式为:_________ ,
②酸雨放置在空气中一段时间其PH会变小后保持不变,请说明原因:
____________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
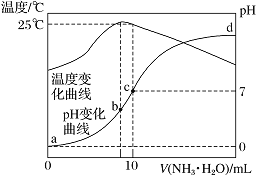
A. n=1.0
B. 水的电离程度:b>c>a>d
C. c点:c(NH)=c(Cl-)=1.0 mol·L-1
D. 25 ℃时,NH4Cl的水解常数(Kh)计算式为=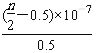
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
U | 第三周期元素的非金属离子还原性最弱 |
(1)写出元素T含有10个中子的原子符号:_________________。写出X与Y形成的化合物的电子式______________。
(2)Y与Z相比,金属性较强的是________(填元素符号),下列表能证明这一事实的是__________(填字母)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质与水反应剧烈
c.Y的化合价比Z低 d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)写出Z与U最高价氧化物对应的水合物相互反应的方程式____________________________
(4)M物质由T、Y、Z三种元素组成,请写出含0.1 mol的M溶液与60mL5 mol·L-1
的盐酸反应的离子反应式________________________________
(5)元素X与氢元素以原子个数比1∶2化合形成常用于火箭燃料的化合物元素T和氢元素以原子个数比为1∶1化合形成化合物Q,Q与W发生氧化还原反应,反应的产物不污染环境,写出该反应的化学方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com