
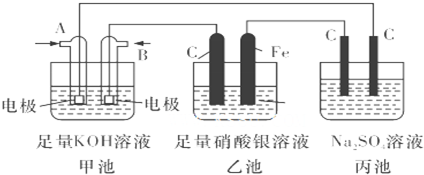
| ||
| 1mol |
| 1L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、m+n>p+q,正反应吸热 |
| B、m+n<p+q,正反应放热 |
| C、m+n>p+q,正反应放热 |
| D、m+n<p+q,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液滴加酚酞试液后显红色,结论:该溶液中一定含OH- |
| B、某无色溶液加入盐酸产生无色无味气体,结论:溶液中一定含有CO32- |
| C、某气体能使品红溶液褪色,结论:该气体为SO2气体 |
| D、向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀,结论:溶液X中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②④⑤ |
| C、②④⑤⑥ | D、②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸体积(mL) | 8 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 112 | 224 | 896 | 2240 | 2240 | 2240 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、途径Ⅰ与途径Ⅱ所得混合气体的百分组成相同 |
| B、途径Ⅰ的反应速率v(N2)与途径Ⅱ的反应速率v(NH3)的比值为1:2 |
| C、途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度之比为1:2 |
| D、途径Ⅰ与途径Ⅱ所得平衡混合气体的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分离KNO3和氯化钠,常用结晶与重结晶 |
| B、提纯含有碘的食盐,常用升华法 |
| C、去除乙醇中的水分离常用蒸馏法 |
| D、苯和酸性高锰酸钾溶液可用分液法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com