

| A、m+n>p+q,正反应吸热 |
| B、m+n<p+q,正反应放热 |
| C、m+n>p+q,正反应放热 |
| D、m+n<p+q,正反应吸热 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
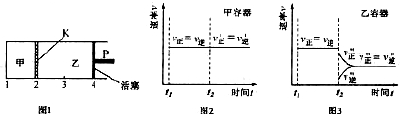
| A、保持温度和活塞位置不变,在甲中再加入 1molA 和 2molB,达到新的平衡后,甲中压强是乙中压强的2倍 |
| B、保持温度和活塞位置不变,t2 时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1 前的反应速率变化已省略) |
| C、保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中 C 的体积分数是甲中C的体积分数的 2 倍 |
| D、保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中气体密度比甲中气体密度的 2 倍小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
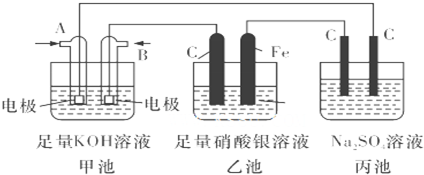
| A、阳极发生还原反应,其电极反应式为:Ni2++2e-═Ni |
| B、电解过程中,阳极质量的减少与阴极质量的增加不相等,但阴阳两极得失电子数目相等 |
| C、电解后,溶液中存在的金属阳离子有Ni2+、Fe2+和Zn2+ |
| D、电解后,电解槽底部的阳极泥中有Cu和Pt |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | |
| 浓度1 | 0.05mol?L-1 | a mol?L-1 | 0.05 mol?L-1 |
| 浓度2 | 0.078 mol?L-1 | 0.078 mol?L-1 | 0.122 mol?L-1 |
| 浓度3 | 0.06 mol?L-1 | 0.06 mol?L-1 | 0.04 mol?L-1 |
| 浓度4 | 0.07 mol?L-1 | 0.07 mol?L-1 | 0.098 mol?L-1 |
| A、由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应 |
| B、由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度 |
| C、[浓度1]中a=0.05 |
| D、该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第IA族碱金属元素最高价氧化物的水化物的碱性随原子序数递增而增强 |
| B、同周期元素(除0族元素外)从左到右,原子半径和离子半径都逐渐减小 |
| C、第ⅦA元素从上到下,其氢化物的稳定性逐渐减弱 |
| D、第ⅦA族元素是同周期中非金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、NO2、CO、烟尘均是大气污染物 |
| B、两支分别蘸有浓盐酸和浓氨水的玻璃棒靠近会产生白烟 |
| C、只用溴水就能区别出乙醇、乙酸、苯三种无色液体 |
| D、一定量的甲烷与氯气光照下发生反应,生成物有五种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验溶液中是否含有SO32-时,用HNO3酸化后再加BaCl2溶液 |
| B、为提高KMnO4溶液的氧化能力,用盐酸酸化KMnO4溶液 |
| C、检验某溶液是否含有Fe3+时,用HNO3酸化后,加KSCN溶液 |
| D、检验溶液中是否含有SO42-时,用HCl酸化后,加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com