
| A、第IA族碱金属元素最高价氧化物的水化物的碱性随原子序数递增而增强 |
| B、同周期元素(除0族元素外)从左到右,原子半径和离子半径都逐渐减小 |
| C、第ⅦA元素从上到下,其氢化物的稳定性逐渐减弱 |
| D、第ⅦA族元素是同周期中非金属性最强的元素 |


科目:高中化学 来源: 题型:
| A、NaNO3 |
| B、Mg(NO3)2 |
| C、Al(NO3)3 |
| D、Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
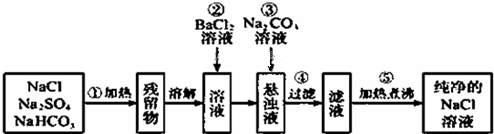
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.7 L |
| B、1.4 L |
| C、1.6 L |
| D、2.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、m+n>p+q,正反应吸热 |
| B、m+n<p+q,正反应放热 |
| C、m+n>p+q,正反应放热 |
| D、m+n<p+q,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| B、为增强高锰酸钾溶液的氧化性,可用盐酸将高锰酸钾溶液酸化 |
| C、将苯与溴水混合后,再加铁粉,即可制得溴苯 |
| D、在测定盐酸和氢氧化钠溶液反应的中和热时,氢氧化钠溶液应过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 2 |
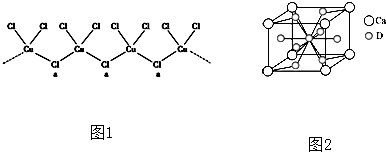
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中不一定含有SO42- |
| B | 向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 | 试纸不变蓝 | 原溶液中无NH4+ |
| C | 向PbO2中滴入浓盐酸 | 有黄绿色气体 | PbO2具有氧化性 |
| D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 有白色沉淀生成 | 溶液X中一定含有CO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②④⑤ |
| C、②④⑤⑥ | D、②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com