
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g?cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |



科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量和摩尔是两个不同的物理量 |
| B、摩尔是物质的量的单位,1摩尔任何物质含6.02x1023个原子 |
| C、阿伏伽德罗常数是人们规定的数,没有单位 |
| D、当H2的摩尔质量以g.mol-1为单位时,在数值上与H2的相对分子质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
| B、向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| C、向20 mL0.15 mol/L氢碘酸中通入224 mL Cl2(标准状况):2HI+Cl2═2H++I2+2Cl- |
| D、向40 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):2OH-+CO2═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
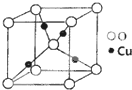 某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.
某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图在甲处的试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入5mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在乙处的试管中加入5mL饱和碳酸钠溶液,按图连接好装置,用酒精灯对甲处的试管缓慢加热,当观察到乙处的试管中有明显现象时停止实验.请回答:
如图在甲处的试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入5mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在乙处的试管中加入5mL饱和碳酸钠溶液,按图连接好装置,用酒精灯对甲处的试管缓慢加热,当观察到乙处的试管中有明显现象时停止实验.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com