
【题目】下列说法正确的是( )
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.常温下反应 C(s)+CO2(g)![]() 2CO(g)不能自发进行,该反应的ΔH>0
2CO(g)不能自发进行,该反应的ΔH>0
C.自发反应的现象一定非常明显,非自发反应的熵一定减小
D.反应(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH=+74.9kJ·mol-1在高温不能自发进行
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】标准状况下将3.36 L硫化氢通入含一定量的氢氧化钠溶液中全部吸收,氢氧化钠也全部反应,然后在低温下小心蒸发,得到不含结晶水的固体10.6 g,问所得固体中含有什么物质__________?其质量各为多少克__________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
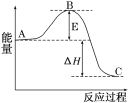
请回答下列问题:
(1)图中A、C分别表示___、___,E的大小对该反应的反应热有无影响?____。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___,理由是____。
(2)图中ΔH=___kJ/mol.
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:____。
(4)如果反应速率v(SO2)为0.05mol/(L·min),则v(O2)=___mol/(L·min)、v(SO3)=____mol/(L·min)。
(5)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3molSO3(g)的ΔH(要求计算过程)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgO、Al2O3、SiO2、Fe2O3组成的混合粉末。现取两份该混合粉末试样进行实验。
(1)将一份混合粉末溶于过量的盐酸,得到沉淀X和滤液Y
①沉淀X为_______(填化学式,下同), 滤液Y中含有的阳离子主要是_______。
②向滤液Y中加入过量氢氧化钠溶液,得到的沉淀是___________。
(2)将另一份混合粉末溶于过量氢氧化钠溶液,发生反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是____________________,该现象说明二氧化硫具有的性质是________________________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气可采用__________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,钠与O2反应可生成1.5 g固体,若将相同质量的钠与80 mL 0.50 mol·L-1的盐酸反应,钠恰好完全转化为NaCl,则1.5 g固体的成分可能是( )
A.Na2OB.Na2O2C.Na2O和Na2O2D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)广泛应用于制药业。其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的Bi(OH)3在NaOH溶液中与Cl2反应制备NaBiO3,并探究其应用与纯度测定。请按要求回答下列问题:
(1)已知:Bi是N同主族元素,周期序数相差4,则Bi的原子序数为__。
Ⅰ.NaBiO3的制备,实验装置如图(加热和夹持仪器已略去)
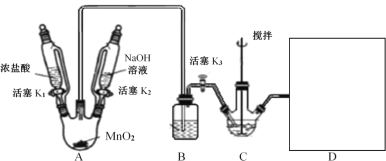
(2)A装置制备的气体是__;B装置的作用是__;补全图中D装置图(并标注试剂名称)___。
(3)C中反应的离子方程式为__。当观察到现象为___时,可以初步判断C中反应已经完成。
(4)反应完成后,处理装置A烧瓶中残留气体需进行的操作:__;为从装置C中获得尽可能多的产品,需进行的操作:__、过滤、洗涤、干燥。
Ⅱ.铋酸钠的应用,检测Mn2+
(5)向含有Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是__;同学甲再向其中滴加MnSO4浓溶液,振荡,观察到紫红色褪去,有黑色固体(MnO2)生成,产生此现象的离子反应方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3(Mr=280)产品ag,加入适量稀硫酸和MnSO4稀溶液使其完全转化为Bi3+,再用bmo1·L-1的H2C2O4标准溶液滴定,当溶液紫红色恰好褪去时(假设Mn元素完全转化为Mn2+),消耗VmL标准溶液。该产品的纯度为__(用含a、b、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
CO(g)+3H2(g) △H>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
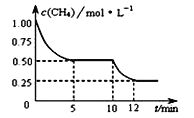
A. 10 min时,改变的外界条件可能是升高温度
B. 反应进行到12min时,CH4的转化率为25%
C. 0∽5 min内,v(H2)=0.1 mol·(L·min)-1
D. 恒温下,缩小容器体积,平衡后H2浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据:
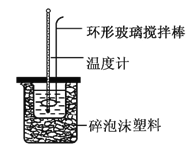
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是__________。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=__[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如果用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_______(填“偏大”、“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是_________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com