
【题目】标准状况下将3.36 L硫化氢通入含一定量的氢氧化钠溶液中全部吸收,氢氧化钠也全部反应,然后在低温下小心蒸发,得到不含结晶水的固体10.6 g,问所得固体中含有什么物质__________?其质量各为多少克__________?
【答案】Na2S和NaHS的混合物 m(Na2S)=7.8g,m(NaHS)=2.8 g
【解析】
标准状况下将3.36L硫化氢气体的物质的量n=![]() =
=![]() =0.15mol,由于硫化氢被完全吸收,而且氢氧化钠也全部反应,故所得的固体物质可能是Na2S或NaHS或两者的混合物,根据硫原子的守恒和最后所得固体的质量,列方程组即可求解。
=0.15mol,由于硫化氢被完全吸收,而且氢氧化钠也全部反应,故所得的固体物质可能是Na2S或NaHS或两者的混合物,根据硫原子的守恒和最后所得固体的质量,列方程组即可求解。
标准状况下,3.36 L硫化氢气体的物质的量n=![]() =
=![]() =0.15 mol,由于硫化氢被完全吸收,而且氢氧化钠也全部反应,故所得的固体物质可能是Na2S或NaHS或两者的混合物。
=0.15 mol,由于硫化氢被完全吸收,而且氢氧化钠也全部反应,故所得的固体物质可能是Na2S或NaHS或两者的混合物。
设所得的固体产物中Na2S为xmol,NaHS为ymol
根据硫原子的守恒:x+y=0.15 mol ①
根据所得固体质量:78x+56y=10.6 g ②
解得x=0.1 mol,y=0.05 mol。
故Na2S的质量m=nM=0.1 mol×78 g·mol-1=7.8g,
NaHS的质量m=nM=0.05 mol×56 g·mol-1=2.8 g,
故答案为:Na2S和NaHS的混合物;m(Na2S)=7.8g,m(NaHS)=2.8 g


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】下表中列出了25 ℃、101 kPa时一些物质的燃烧热数据:
物质 | CH4(g) | CH3OCH3(g) | H2(g) | HC≡CH(g) |
燃烧热/(kJ·mol-1) | 890.3 | 1 453.0 | 285.8 | 1 299.6 |
已知:①1 mol液态水变为气态水要吸收44.0 kJ的热量;
②键能:C—H键 413.4 kJ·mol-1、H—H键 436.0 kJ·mol-1。
下列叙述错误的是
A. CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1 453.0 kJ·mol-1
B. C≡C键的键能为786.0 kJ·mol-1
C. 2CH4(g)+O2(g)=CH3OCH3(g)+H2O(g) ΔH=-283.6 kJ·mol-1
D. H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1 mol A和1 mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) ![]() 2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
A. 起始时刻和达到平衡后容器中的压强比为1:1
B. 物质A、B的转化率之比一定是1:2
C. 若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C
D. 当v正(A)=v逆(B)时,可断定反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(图中夹持装置已略去)。将B处的三氧化二铬加热至红热,再鼓入空气,已知:无水氯化钙可吸收氨气和水。回答下列问题:
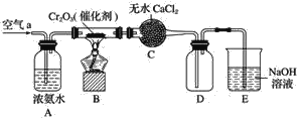
(1)B中发生反应的化学方程式是________________________________。
(2)证明氨气发生了催化氧化的现象是____________________________。
(3)写出(2)中反应的化学方程式______________________。
(4)装置E作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气.
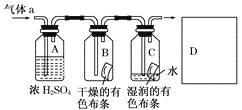
回答下列问题:
(1)该项研究(实验)的主要目的是__________________________________________.
(2)浓硫酸的作用是____________________________________________,与研究目的的直接相关的实验现象是________________________________________.
(3)从物质性质的方面来看,这样的实验设计存在着事故隐患,事故表现是___________,请在图中D框中以图的形式表明克服事故隐患的措施___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________,砷属于________区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能 |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为___________________________。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如![]() ,
,![]() ,
,![]() 等。其中所含元素铜的第二电离能________(填“大于”“小于”或“等于”)锌的第二电离能。
等。其中所含元素铜的第二电离能________(填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原![]() 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体![]() 。该晶体所含元素中,电负性最大的元素是________,与Ti形成配位键的配体是________,
。该晶体所含元素中,电负性最大的元素是________,与Ti形成配位键的配体是________,![]() 该配合物中含有
该配合物中含有![]() 键的数目为________。
键的数目为________。
(5)![]() 能形成多种配离子,如
能形成多种配离子,如![]() ,
,![]() 等。
等。![]() 的空间构型为:________;与
的空间构型为:________;与![]() 互为等电子体的分子有:___________________(填分子式)。
互为等电子体的分子有:___________________(填分子式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示![]() ,白色球表示
,白色球表示![]() ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________![]() (用
(用![]() 表示阿伏加德罗常数)
表示阿伏加德罗常数)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.常温下反应 C(s)+CO2(g)![]() 2CO(g)不能自发进行,该反应的ΔH>0
2CO(g)不能自发进行,该反应的ΔH>0
C.自发反应的现象一定非常明显,非自发反应的熵一定减小
D.反应(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH=+74.9kJ·mol-1在高温不能自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com