
【题目】下表中列出了25 ℃、101 kPa时一些物质的燃烧热数据:
物质 | CH4(g) | CH3OCH3(g) | H2(g) | HC≡CH(g) |
燃烧热/(kJ·mol-1) | 890.3 | 1 453.0 | 285.8 | 1 299.6 |
已知:①1 mol液态水变为气态水要吸收44.0 kJ的热量;
②键能:C—H键 413.4 kJ·mol-1、H—H键 436.0 kJ·mol-1。
下列叙述错误的是
A. CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1 453.0 kJ·mol-1
B. C≡C键的键能为786.0 kJ·mol-1
C. 2CH4(g)+O2(g)=CH3OCH3(g)+H2O(g) ΔH=-283.6 kJ·mol-1
D. H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
【答案】B
【解析】
A项、根据表中信息可写出表示二甲醚燃烧热的热化学方程式:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1 453.0 kJ·mol-1,故A正确;
B项、CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol-1 ①,C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1 299.6 kJ·mol-1 ②,H2(g)+
O2(g)=2CO2(g)+H2O(l) ΔH=-1 299.6 kJ·mol-1 ②,H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 ③,根据盖斯定律,由②+③×3-①×2可得:C2H2(g)+3H2(g)=2CH4(g) ΔH=-376.4 kJ·mol-1,根据ΔH=反应物总键能-生成物总键能,可得C≡C键的键能+2×413.4 kJ·mol-1+3×436.0 kJ·mol-1-8×413.4 kJ·mol-1=-376.4 kJ·mol-1,则C≡C键的键能=796.0 kJ·mol-1,故B错误;
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 ③,根据盖斯定律,由②+③×3-①×2可得:C2H2(g)+3H2(g)=2CH4(g) ΔH=-376.4 kJ·mol-1,根据ΔH=反应物总键能-生成物总键能,可得C≡C键的键能+2×413.4 kJ·mol-1+3×436.0 kJ·mol-1-8×413.4 kJ·mol-1=-376.4 kJ·mol-1,则C≡C键的键能=796.0 kJ·mol-1,故B错误;
C项、CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 a,CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1 453.0 kJ·mol-1 b,H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1 c,根据盖斯定律,由a×2-b+c可得:2CH4(g)+O2(g)=CH3OCH3(g)+H2O(g) ΔH=-283.6 kJ·mol-1,故C正确;
D项、H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1,故D正确。
故选B。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】在温度不变、恒容的容器中进行反应2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 sB.等于12 sC.大于12 sD.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是298K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为____。
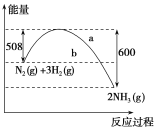
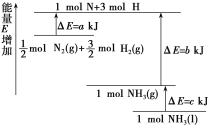
(2)化学反应N2+3H2![]() 2NH3的能量变化如图所示(假设该反应反应完全),试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:____。
2NH3的能量变化如图所示(假设该反应反应完全),试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
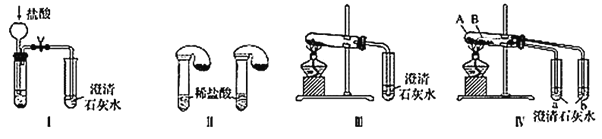
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为__________;与实验Ⅲ相比,实验Ⅳ的优点是_____(填字母)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式),实验过程中的现象为__________。
(4)除了以上方法,请你再举出一例鉴别二者的方法:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、科技及环境密切相关。下列说法正确的是( )
A.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
B.白葡萄酒含维生素C等多种维生素,通常添加微量![]() 的目的是防止营养成分被氧化
的目的是防止营养成分被氧化
C.酒精与84消毒液混合,可增强杀灭新型冠状病毒效果
D.聚合硫酸铁![]() ,是新型絮凝剂,可用来杀灭水中病菌
,是新型絮凝剂,可用来杀灭水中病菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉和硫粉的混合物共热,充分反应后冷却,再加入足量的稀硫酸,得到标准状况下的气体11.2 L,则原混合物可能的组成是(n代表物质的量)( )
A.n(Fe)<n(S),总质量等于44 g
B.n(Fe)>n(S),总质量等于44 g
C.n(Fe)=n(S),总质量小于44 g
D.n(Fe)>n(S),总质量小于44 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )
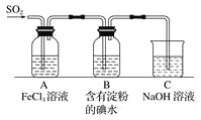
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,H2SO3的电离常数Ka1=1.23![]() 10-2,Ka2=5.6
10-2,Ka2=5.6![]() 10-8,HClO的电离常数Ka=2.98
10-8,HClO的电离常数Ka=2.98![]() 10-8,下列说法错误的是
10-8,下列说法错误的是
A.常温下,相同浓度的H2SO3 比HClO酸性强
B.常温下,将NaHSO3溶液滴入到NaClO溶液中不发生化学反应
C.常温下,NaHSO3溶液中HSO3-的电离程度大于其水解程度,NaHSO3溶液呈酸性
D.将pH=5的HClO溶液加水稀释到pH=6时,溶液中部分离子浓度会升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将3.36 L硫化氢通入含一定量的氢氧化钠溶液中全部吸收,氢氧化钠也全部反应,然后在低温下小心蒸发,得到不含结晶水的固体10.6 g,问所得固体中含有什么物质__________?其质量各为多少克__________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com