
【题目】某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气.
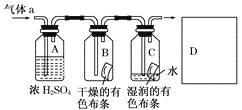
回答下列问题:
(1)该项研究(实验)的主要目的是__________________________________________.
(2)浓硫酸的作用是____________________________________________,与研究目的的直接相关的实验现象是________________________________________.
(3)从物质性质的方面来看,这样的实验设计存在着事故隐患,事故表现是___________,请在图中D框中以图的形式表明克服事故隐患的措施___________。
【答案】判断Cl2和HClO哪种物质漂白性 吸收气体a中的水蒸气 B内布条不褪色,C内的布条褪色 多余的Cl2污染空气 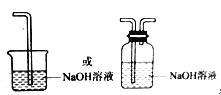
【解析】
(1)本实验的目的是探究氯气具有漂白性的条件下,干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性;
(2)浓硫酸具有吸水性,干燥的氯气不具有漂白性,据此进行解答;
(3)氯气有毒,不能排放在空气中,在D中可以用氢氧化钠溶液吸收多余的氯气。
(1)由B、C可知起对比作用,则该实验的目的为比较Cl2和HClO谁有漂白性,
故答案为:探究氯气具有漂白性的条件;
(2)浓硫酸具有吸水性,其作用为吸收气体中的水蒸汽干燥氯气,干燥的氯气不具有漂白性,则与研究目的直接相关的实验现象是B中的布条不褪色,C中的布条褪色,
故答案为:干燥氯气;B中有色布条不退色,C中有色布条退色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,应加尾气处理装置,如图 ,
,
故答案为:氯气外逸,污染环境;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学与生活、科技及环境密切相关。下列说法正确的是( )
A.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
B.白葡萄酒含维生素C等多种维生素,通常添加微量![]() 的目的是防止营养成分被氧化
的目的是防止营养成分被氧化
C.酒精与84消毒液混合,可增强杀灭新型冠状病毒效果
D.聚合硫酸铁![]() ,是新型絮凝剂,可用来杀灭水中病菌
,是新型絮凝剂,可用来杀灭水中病菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:
(1)钴原子的基态电子排布式为_______________________。
(2)![]() 有________几种不同的运动状态的电子,
有________几种不同的运动状态的电子,![]() 比
比![]() 更稳定的原因是_________。
更稳定的原因是_________。
(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为_________(用元素符号表示)。
(4)![]() 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体![]() 属于______晶体。
属于______晶体。![]() 的空间构型为_____。
的空间构型为_____。
(5) ![]() 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。![]() 分子中S的杂化方式为______。每个
分子中S的杂化方式为______。每个![]() 分子中含有的孤电子对的数目为_________。
分子中含有的孤电子对的数目为_________。


(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为____________。若该晶胞的边长为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,则该氧化物的密度为_________
,则该氧化物的密度为_________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出图1中序号①~④仪器的名称:①__;②__;③__;④__。在仪器①~④中,使用前必须检查是否漏水的有__(填仪器序号)。
(2)图2是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上(密度1.84 g·cm-3,质量分数98%)的部分内容,现用该浓硫酸配制480 mL 1 mol·L﹣1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
a.图3中盛放浓硫酸的试剂瓶标签上应该印有图警示标记中的__(写标记代号A~D)。
b.配制稀硫酸时,除了上述仪器,还缺少的仪器有__、__(写仪器名称)。
c.经计算,配制480 mL 1 mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为__mL(保留一位小数点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将3.36 L硫化氢通入含一定量的氢氧化钠溶液中全部吸收,氢氧化钠也全部反应,然后在低温下小心蒸发,得到不含结晶水的固体10.6 g,问所得固体中含有什么物质__________?其质量各为多少克__________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数,下列有关说法正确的是( )
为阿伏加德罗常数,下列有关说法正确的是( )
A.![]() 的
的![]() 溶液中
溶液中![]() 和
和![]() 离子数之和为
离子数之和为![]()
B.常温下,![]() 的
的![]() 溶液中,发生电离的水分子数为
溶液中,发生电离的水分子数为![]()
C.氢氧燃料电池负极消耗![]() 气体时,电路中转移的电子数为
气体时,电路中转移的电子数为![]()
D.用情性电极电解![]() 溶液后,如果加入
溶液后,如果加入![]() 能使溶液复原,则电路中转移的电子数为
能使溶液复原,则电路中转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是____________________,该现象说明二氧化硫具有的性质是________________________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气可采用__________溶液吸收。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com