
| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
| c2(CO) |
| c(CO2) |
| c(H2)×c(CO2) |
| c(CO)×c(H2O) |
| c(CO)×c(H2) |
| c(H2O) |
| ||
| L |
| mL |
| 10-14 | ||
|
| ||
| 1min |
| c2(NH3) |
| c(N2)×c3(H2) |
| 0.52 |
| 0.5×1.53 |
| 12 |
| 1×23 |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、Fe2+失去电子的物质的量为2 mol |
| B、Cl2得电子的物质的量为1 mol |
| C、参加反应的Cl2的物质的量为1mol |
| D、氧化剂与还原剂的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3═Na++H++CO32- |
| B、Al2(SO4)3═2Al3++3SO42- |
| C、NaHS?Na++HS- |
| D、Ca(OH)2═Ca2++(OH)22- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
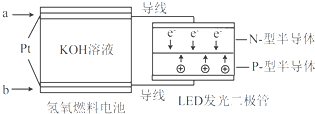
| A、a处通入O2 |
| B、b处为电池正极,发生了还原反应 |
| C、通入O2的电极发生反应:O2+4e-+4H+=2H2O |
| D、该装置将化学能最终转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
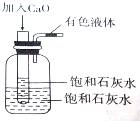 将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.
将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A、反应在第2 min到第4min时,O2 的平均反应速率为0.1875 mol/(L?min) |
| B、反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度 |
| C、第4 min时、第8 min时分别达到化学平衡,且平衡常数相同 |
| D、在开始反应的前2 min内,该反应的放出0.05Q kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、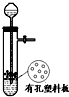 用于Cu和浓H2SO4反应制取少量的SO2气体 |
B、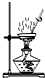 用于灼烧Al(OH)3 |
C、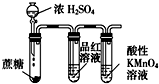 用于检验浓硫酸与蔗糖反应产生的二氧化硫 |
D、 由于实验室制备乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com