
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A、反应在第2 min到第4min时,O2 的平均反应速率为0.1875 mol/(L?min) |
| B、反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度 |
| C、第4 min时、第8 min时分别达到化学平衡,且平衡常数相同 |
| D、在开始反应的前2 min内,该反应的放出0.05Q kJ的热量 |
| Q |
| 4 |
| 0.3mol/L |
| 2min |
| 5 |
| 4 |
| 5 |
| 4 |
| 0.54×0.756 |
| 0.34×0.9755 |
| 0.14×0.156 |
| 0.74×1.4755 |
| Q |
| 4 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、高温下,0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA | ||||
| B、MnO2与浓盐酸共热,0.4 molHCl被氧化时,转移电子数目为0.4 NA | ||||
| C、5.6g铁片投入足量浓H2SO4中,转移电子数目为0.3 NA | ||||
D、5NH4NO3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
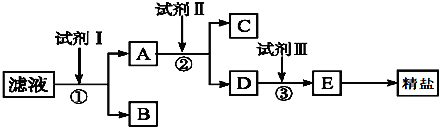
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 |
| B、反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 |
| C、由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 |
| D、25℃时,0.1 mol?L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 是一种白色晶体,其酸及盐均为强氧化剂.
是一种白色晶体,其酸及盐均为强氧化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C(s)+
| ||
| B、2H2(g)+O2(g)═2H2O(g)△H=+571.6kJ/mol | ||
| C、C2H4(g)+3O2(g)═2CO2(g)+2H2O(g)△H=-1411.0kJ/mol-1 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入足量的Zn粒,产生标况下112mLH2 |
| B、加入NaOH固体后醋酸电离平衡右移,pH减小 |
| C、与一定量盐酸混合后pH=1,此时c(CH3COO-)+c(Cl-)+c(OH-)=0.1mol/L |
| D、加入冰醋酸,电离程度增大,pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com