
【题目】根据题意填空
(1)环境专家认为可以用铝将水中的NO3﹣ 转化为N2 , 从而清除污染.该反应中涉及的粒子有:H2O,Al、OH﹣、Al(OH)3、NO3﹣、N2 , 请将各粒子分别填入以下空格.
NO3﹣++→++该反应过程中,被氧化与被还原的元素的物质的量之比为 .
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
Fe2O3(s)+ ![]() C(s)=
C(s)= ![]() CO2(g)+2Fe (s)△H=+b KJ/mol
CO2(g)+2Fe (s)△H=+b KJ/mol
C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: .
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为L(标准状况). 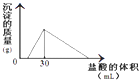
【答案】
(1)10Al;18H2O;10Al(OH)3;3N2;6OH﹣;5:3
(2)Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=﹣( ![]() a﹣b﹣
a﹣b﹣ ![]() c)KJ/mol
c)KJ/mol
(3)2.016
【解析】解:(1)反应中NO3﹣→N2 , N元素化合价由+5价降低为0价,共降低10价,Al→Al(OH)3 , Al元素化合价由0价升高为+3价,共升高3价,根据电荷守恒可知OH﹣是生成物,由H元素守恒可知H2O是反应物,化合价升降最小公倍数为30,故N2系数为3,Al系数为10,根据N元素守恒可知NO3﹣系数为6,根据Al元素守恒可知Al(OH)3系数为10,电荷守恒可知OH﹣系数为6,根据H元素守恒可知H2O系数为,配平后离子方程式为6NO3﹣+10Al+18H2O=10Al(OH)3+3N2+6OH﹣ . 由方程式可知被氧化与被还原的元素的物质的量之比10:6=5:3.所以答案是:10Al、18H2O=10Al(OH)3、3N2、6OH﹣;5:3.(2)已知:①4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol②Fe2O3(s)+ ![]() C(s)=
C(s)= ![]() CO2(g)+2Fe (s)△H=+b KJ/mol③C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol由盖斯定律可知,②﹣③×
CO2(g)+2Fe (s)△H=+b KJ/mol③C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol由盖斯定律可知,②﹣③× ![]() +①×
+①× ![]() 得:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=﹣(
得:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=﹣( ![]() a﹣b﹣
a﹣b﹣ ![]() c)KJ/mol.所以答案是:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=﹣(
c)KJ/mol.所以答案是:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=﹣( ![]() a﹣b﹣
a﹣b﹣ ![]() c)KJ/mol.(3)由图可知加入盐酸不与立刻生成沉淀,说明盐酸先中和氢氧化钠,故合金全部溶解所得溶液为氢氧化钠与偏铝酸钠混合溶液,溶液中n(Na+)=n(OH﹣)+n(AlO2﹣),当加入盐酸30mL时,沉淀量最大,此时溶液为氯化钠溶液,根据氯元素守恒有n(NaCl)=n(HCl)=0.03L×2mol/L=0.06mol,根据钠元素守恒有n(NaCl)=n(Na)=n(Na+)=0.06mol,PH=14的溶液中c(OH﹣)=1mol/L,n(OH﹣)=0.02L×1mol/L=0.02mol,所以n(AlO2﹣)=0.06mol﹣0.02mol=0.04mol,所以n(Al)=n(AlO2﹣)=0.04mol,根据电子转移守恒n(H2)×2=n(Na)×1+n(Al)×3,2n(H2)=0.06mol+0.04mol×3=0.18mol,故n(H2)=0.09mol,V(H2)=0.09mol×22.4L/mol=2.016L.所以答案是:2.016.
c)KJ/mol.(3)由图可知加入盐酸不与立刻生成沉淀,说明盐酸先中和氢氧化钠,故合金全部溶解所得溶液为氢氧化钠与偏铝酸钠混合溶液,溶液中n(Na+)=n(OH﹣)+n(AlO2﹣),当加入盐酸30mL时,沉淀量最大,此时溶液为氯化钠溶液,根据氯元素守恒有n(NaCl)=n(HCl)=0.03L×2mol/L=0.06mol,根据钠元素守恒有n(NaCl)=n(Na)=n(Na+)=0.06mol,PH=14的溶液中c(OH﹣)=1mol/L,n(OH﹣)=0.02L×1mol/L=0.02mol,所以n(AlO2﹣)=0.06mol﹣0.02mol=0.04mol,所以n(Al)=n(AlO2﹣)=0.04mol,根据电子转移守恒n(H2)×2=n(Na)×1+n(Al)×3,2n(H2)=0.06mol+0.04mol×3=0.18mol,故n(H2)=0.09mol,V(H2)=0.09mol×22.4L/mol=2.016L.所以答案是:2.016.


科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.![]() =1×10﹣13mol?L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
=1×10﹣13mol?L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣
D.水电离的c(H+)=1×10﹣13mol?L﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列电解质溶液:①Na 2CO3 ②NaHCO3 ③苯酚钠(不与碱反应) ④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
(2)已知:酸性H2CO3>苯酚>HCO3﹣ . 常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填写序号):
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4 溶液呈中性,根据这一事实推测⑤溶液的pH7(填>、=或<),理由是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
烃A的分子量为92且所有碳原子都在同一平面上。一种由烃A制备水杨酸的过程如下:
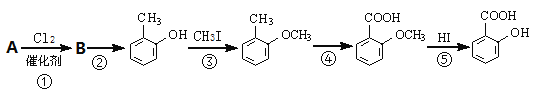
(1)请写出由A生成B的反应方程式:_____________________________________________。
(2)在合成线路中,设计第③和第⑤这两步反应的目的是 :__________________________。
(3)若与水杨酸相关的转化关系如下:
 请写出下列反应方程式
请写出下列反应方程式
由水杨酸生成D的化学反应方程式:_________________________________。
①处发生反应的化学方程式:______________________________________;
⑤处发生反应的化学方程式:________________________________;
该反应类型为:__________。
(4)请写出同时符合下列要求的水杨酸的所有同分异构体的结构简式:_________________。
①滴入FeCl3 溶液,混合液显紫色
②能发生银镜反应,不能发生水解反应
③苯环上一氯代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下列物质中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l) E.BaSO4(s) F.NaHSO4(s) G.石墨(s) H.蔗糖(s) I.NaOH(l)
(1)属于非电解质的是____________(填序号,下同),属于强电解质的是____________,属于弱电解质的是____________。
(2)能直接导电的是________________,能溶于水,且水溶液能导电的是________________。
Ⅱ、 根据下列事实,完成相关的离子方程式或电离方程式
(1)Na2S溶液使酚酞显红色_________________________________。
(2)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NH4Cl溶液中,离子浓度大小排队正确的是( )
A. c(NH4+)> c(Cl-)> c(OH-)> c(H+)
B. c(Cl-)> c(NH4+)> c(OH-)> c(H+)
C. c(Cl-)>c(NH4+)> c(H+)> c(OH-)
D. c(NH4+)> c(Cl-)> c(H+)> c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com