
【题目】现有下列电解质溶液:①Na 2CO3 ②NaHCO3 ③苯酚钠(不与碱反应) ④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
(2)已知:酸性H2CO3>苯酚>HCO3﹣ . 常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填写序号):
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4 溶液呈中性,根据这一事实推测⑤溶液的pH7(填>、=或<),理由是: .
【答案】
(1)②④⑤
(2)①>③>②
(3)NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O
NH3↑+CO32﹣+2H2O
(4)>;CH3COONH4溶液呈中性,说明CH3COO﹣和NH4+水解程度相同,H2CO3酸性弱于CH3COOH,所以HCO3﹣的水解程度大于CH3COO﹣ , 因此NH4HCO3溶液的pH>7.
【解析】解:(1)HCO3﹣既不与酸共存,也不与碱共存;NH4+不与碱共存,CH3COONH4为弱酸弱碱盐,故既能与盐酸反应,又能与烧碱反应的电解质有②④⑤,所以答案是:②④⑤;(2)①、②、③都是能水解的盐,溶液pH的大小,取决于盐溶液中阴离子的水解程度,水解程度越大,溶液pH越大,酸性H2CO3>苯酚>HCO3﹣ , 则对应的盐越易水解,pH:①>③>②;所以答案是:①>③>②;(3)NH4HCO3与足量NaOH溶液混合加热产生氨气,反应的离子方程式为NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O,所以答案是:NH4++HCO3﹣+2OH﹣
NH3↑+CO32﹣+2H2O,所以答案是:NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O;(4)CH3COONH4是弱酸弱碱盐,溶液呈中性,说明CH3COO﹣和NH4+水解程度相同,但H2CO3酸性弱于CH3COOH,HCO3﹣的水解程度大于CH3COO﹣ , 所以NH4HCO3溶液pH>7,所以答案是:>;CH3COONH4溶液呈中性,说明CH3COO﹣和NH4+水解程度相同,H2CO3酸性弱于CH3COOH,所以HCO3﹣的水解程度大于CH3COO﹣ , 因此NH4HCO3溶液的pH>7.
NH3↑+CO32﹣+2H2O;(4)CH3COONH4是弱酸弱碱盐,溶液呈中性,说明CH3COO﹣和NH4+水解程度相同,但H2CO3酸性弱于CH3COOH,HCO3﹣的水解程度大于CH3COO﹣ , 所以NH4HCO3溶液pH>7,所以答案是:>;CH3COONH4溶液呈中性,说明CH3COO﹣和NH4+水解程度相同,H2CO3酸性弱于CH3COOH,所以HCO3﹣的水解程度大于CH3COO﹣ , 因此NH4HCO3溶液的pH>7.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下图装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:

(1)c极的电极反应式为________ 。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,电解进行一段时间后,你能观察到的
现象是:___________,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应式为_____________。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了____moL气体,
此时若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为___________。
此时A池中溶液氢离子的浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向a mL 0.10mol/L的稀氨水中逐滴加入 b mL 0.10mol/L的稀盐酸,试分析:
(1)当b=a时,溶液呈(填“酸”“碱”或“中”)性,此时溶液中,c( ![]() )(填“>”“<”或“=”)c(Cl﹣).
)(填“>”“<”或“=”)c(Cl﹣).
(2)当溶液呈中性时,a(填“>”“<”或“=”)b,此时溶液中c( ![]() )c(Cl﹣)(同上).
)c(Cl﹣)(同上).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
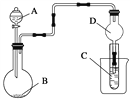
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果2 mol物质A的质量为56g,则物质A的摩尔质量是__________ ,
42g 物质A的物质的量是________ ,0.5 mol物质A的质量是_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)环境专家认为可以用铝将水中的NO3﹣ 转化为N2 , 从而清除污染.该反应中涉及的粒子有:H2O,Al、OH﹣、Al(OH)3、NO3﹣、N2 , 请将各粒子分别填入以下空格.
NO3﹣++→++该反应过程中,被氧化与被还原的元素的物质的量之比为 .
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
Fe2O3(s)+ ![]() C(s)=
C(s)= ![]() CO2(g)+2Fe (s)△H=+b KJ/mol
CO2(g)+2Fe (s)△H=+b KJ/mol
C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: .
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为L(标准状况). 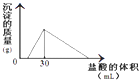
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得BeCl2为共价化合物,则BeCl2属于( )
A.由极性键构成的极性分子B.由极性键构成的非极性分子
C.由非极性键构成的极性分子D.由非极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下表溶液中的杂质,写出所加试剂(适量)的化学式和有关离子方程式:
组别 | 溶液 | 杂质 | 应加试剂 | 离子方程式 |
(1) | Na2SO4 | Na2CO3 | ____ | _____ |
(2) | KCl | K2SO4 | ____ | _____ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com