
| A、胶体:能否产生丁达尔现象 |
| B、离子化合物:是否含有离子键 |
| C、电解质:水溶液是否导电 |
| D、原子晶体:组成微粒是否为原子 |


科目:高中化学 来源: 题型:
| A、常温常压下,22.4LCO2中含有NA个CO2分子 |
| B、室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| C、标准状况下,11.2L氦气中约含有NA个氦原子 |
| D、1L0.1mol?L-1Na2SO3溶液中含有0.1NA个SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钙是人体内含量最丰富的元素之一 |
| B、在人体内钙构成骨骼和牙齿 |
| C、缺钙的人可以多喝牛奶、豆奶等乳制品补钙 |
| D、钙是人体内公认的“智慧元素” |
查看答案和解析>>
科目:高中化学 来源: 题型:

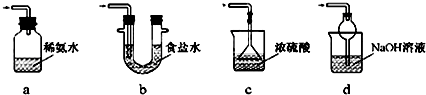
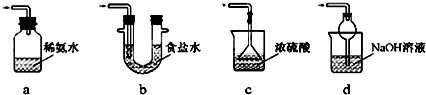
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用试管取出试剂瓶中的NaOH溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、银镜反应实验后的废液可先倒入水槽中,再用水冲入下水道 |
| C、向试管中滴加液体时,胶头滴管必须紧贴试管内壁,避免液体溅出 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(N2)=0.01mol/(L?s),v(H2)=0.02mol/(L?s) |
| B、v(H2)=0.02mol/(L?s),v(NH3)=1.2mol/(L?min) |
| C、v(N2)=0.01mol/(L?s),v(NH3)=1.2mol/(L?min) |
| D、v(H2)=0.06mol/(L?s),v(NH3)=0.4mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
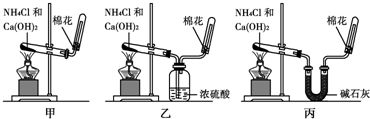
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com