
【题目】在50mL bmolL﹣1的AlCl3溶液中加入50mL amolL﹣1 NaOH溶液.
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为mol.
(2)当a、b满足条件时,无沉淀产生.
(3)当a、b满足条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量为克.
【答案】
(1)![]()
(2)a=4b或a>4b
(3)3b<a<4b;3.9(4b﹣a)
【解析】解:(1)在化学反应中,参加反应的物质的物质的量之比=化学计量数之比.AlCl3和NaOH反应,3NaOH+AlCl3=Al(OH)3+3NaCl,
当AlCl3和NaOH恰好反应即物质的量之比为1:3时,生成的Al(OH)3 物质的量最大.当a≤3b时,反应中NaOH不足量,计算时应以NaOH为标准进行,
设生成Al(OH)3沉淀的物质的量为x.
3NaOH+AlCl3= | Al(OH)3+3NaCl |
3 | 1 |
0.05×a | x |
3:1=0.05×a:x
解得 x= ![]() mol,
mol,
所以答案是: ![]() ;(2)AlCl3和NaOH反应生成Al(OH)3,Al(OH)3是两性氢氧化物,能够溶于NaOH溶液,所以生成的沉淀会减少,NaOH+Al(OH)3=NaAlO2+2H2O,
;(2)AlCl3和NaOH反应生成Al(OH)3,Al(OH)3是两性氢氧化物,能够溶于NaOH溶液,所以生成的沉淀会减少,NaOH+Al(OH)3=NaAlO2+2H2O,
方程式3NaOH+AlCl3=Al(OH)3+3NaCl和 NaOH+Al(OH)3=NaAlO2+2H2O 相加,得到方程式4NaOH+AlCl=NaAlO2+3NaCl+2H2O,由方程式可得,
当AlCl3和NaOH物质的量之比为1:4时,恰好没有沉淀产生.
4NaOH+ | AlCl3=NaAlO2+3NaCl+2H2O |
4 | 1 |
0.05a | 0.05b |
a:b=4:1
所以答案是:a=4b或a>4b;(3)先有沉淀生成,3NaOH+AlCl3=Al(OH)3+3NaCl,后又有部分沉淀溶解,NaOH+Al(OH)3=NaAlO2+2H2O
所以3b<a<4b时,会出现先有沉淀生成后又有部分沉淀溶解,当全部生成沉淀时,应以AlCl3为标准进行计算,
当沉淀生成后又有部分沉淀溶解时,应以剩余的NaOH为标准进行计算.
设AlCl3全部转化为Al(OH)3时,需要的NaOH为xmol,生成的Al(OH)3为ymol,
3NaOH+ | AlCl3= | Al(OH)3+3NaCl |
3 | 1 | 1 |
x | 0.05b | y |
x=0.15b y=0.05b
剩余NaOH的物质的量为:0.05a﹣0.15b,
设生成NaAlO2时需要的Al(OH)3物质的量为zmol,
NaOH+ | Al(OH)3=NaAlO2+2H2O |
1 | 1 |
0.05a﹣0.15b | z |
z=0.05a﹣0.15b
所以剩余的Al(OH)3物质的量为0.05b﹣(0.05a﹣0.15b )=0.2b﹣0.05a,质量为 (0.2b﹣0.05a)×78=3.9(4b﹣a),
所以答案是:3b<a<4b;3.9(4b﹣a).


科目:高中化学 来源: 题型:
【题目】已知反应2H2O2 = 2H2O+O2↑,下列条件中,反应速率最快的是( )
A. 10 ℃,5 mL 3% H2O2溶液B. 10 ℃,5 mL 5% H2O2溶液
C. 30 ℃,10 mL 5% H2O2溶液D. 30 ℃,5 mL 5% H2O2溶液且加入少量MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜. (一)制备苯甲酸乙酯![]() +C2H5OH
+C2H5OH ![]()
![]() +H2O
+H2O
相关物质的部分物理性质如上表格:
催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
达到平衡所需要时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化剂 | |
实验流程如下:
(1)制备苯甲酸乙酯,下列装置最合适的是 , 反应液中的环己烷在本实验中的作用 . 
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是 .
(3)步骤③碳酸钠的作用是 , 碳酸钠固体需搅拌下分批加入的原因 .
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用 .
(5)步骤⑤蒸馏操作中,下列装置最好的是(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用(水浴加热、直接加热、油浴加热). 
(6)(二)制备苯甲酸铜 将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
混合溶剂中乙醇的作用是 , 趁热过滤的原因
(7)本实验中下列药品不能代替氢氧化铜使用的是
A.醋酸铜
B.氧化铜
C.碱式碳酸铜
D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是
A.冷水
B.热水
C.乙醇
D.乙醇水混合溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
A.2Na218O2+2H2O═4Nal8OH+O2↑
B.NH4Cl+2H2O═NH32H2O+HCl
C.2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2↑+8H2O
D.K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题. 
(1)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2 , 制得的Cl2体积(标准状况下)总是小于1.12L的原因是 .
(2)①装置B中盛放的试剂名称为 , 作用是 , 现象是 . ②装置D和E中出现的不同现象说明的问题是 .
③装置F的作用是 .
④写出装置G中发生反应的离子方程式 .
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在与之间(填装置字母序号),装置中应放入(填写试剂或用品称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32﹣、NO3﹣、Cl﹣、I﹣、SO42﹣中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( ) 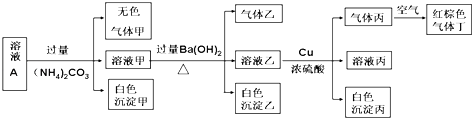
A.沉淀乙一定有BaCO3 , 可能有BaSO4
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.该溶液中一定有NO3﹣、Al3+、SO42﹣、Cl﹣四种离子
D.生成的甲、乙、丙气体均为无色的易溶于水气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是( ) 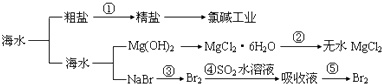
A.第①步中除去粗盐中的SO42﹣、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.工业上金属钠是通过氯碱工业制取
C.从第③步到第⑤步的目的是为了浓缩
D.在第③④⑤步中溴元素均被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com