
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式__________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)![]() SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
3SiH2Cl2(g)![]() SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
则反应4SiHCl3(g)![]() SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
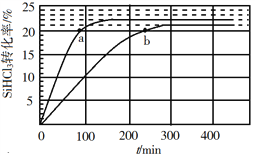
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________;要缩短反应达到平衡的时间,可采取的措施有____________、___________。
③比较a、b处反应速率大小:υa________υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]()
![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
【答案】 2SiHCl3+3H2O![]() (HSiO)2O+6HCl 114 ①22 0.02 ②及时移去产物 改进催化剂 提高反应物压强(浓度) ③大于 1.3
(HSiO)2O+6HCl 114 ①22 0.02 ②及时移去产物 改进催化剂 提高反应物压强(浓度) ③大于 1.3
【解析】分析:本题考查的是化学反应原理的综合应用,主要包括反应与能量以及化学反应速率、平衡的相关内容。只需要根据题目要求,利用平衡速率的方法进行计算即可。
详解:(1)根据题目表述,三氯氢硅和水蒸气反应得到(HSiO)2O,方程式为:2SiHCl3+3H2O=(HSiO)2O+6HCl。
(2)将第一个方程式扩大3倍,再与第二个方程式相加就可以得到第三个反应的焓变,所以焓变为48×3+(-30)=114kJ·mol-1。
(3)①由图示,温度越高反应越快,达到平衡用得时间就越少,所以曲线a代表343K的反应。从图中读出,平衡以后反应转化率为22%。设初始加入的三氯氢硅的浓度为1mol/L,得到:
2SiHCl3 ![]() SiH2Cl2 + SiCl4
SiH2Cl2 + SiCl4
起始: 1 0 0
反应: 0.22 0.11 0.11 (转化率为22%)
平衡: 0.78 0.11 0.11
所以平衡常数K=0.112÷0.782=0.02。
②温度不变,提高三氯氢硅转化率的方法可以是将产物从体系分离(两边物质的量相等,压强不影响平衡)。缩短达到平衡的时间,就是加快反应速率,所以可以采取的措施是增大压强(增大反应物浓度)、加入更高效的催化剂(改进催化剂)。
③a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即Va>Vb。根据题目表述得到![]() ,
,![]() ,当反应达平衡时
,当反应达平衡时![]() ,
,![]() =
=![]() ,所以
,所以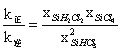 ,实际就是平衡常数K值,所以
,实际就是平衡常数K值,所以![]() 0.02。a点时,转化率为20%,所以计算出:
0.02。a点时,转化率为20%,所以计算出:
2SiHCl3 ![]() SiH2Cl2 + SiCl4
SiH2Cl2 + SiCl4
起始: 1 0 0
反应: 0.2 0.1 0.1 (转化率为20%)
平衡: 0.8 0.1 0.1
所以![]() =0.8;
=0.8;![]() =
=![]() =0.1;所以
=0.1;所以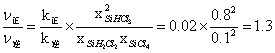


科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
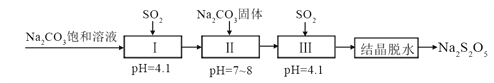
①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
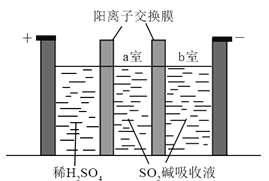
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol钠、镁、铝分别投入到100mL 1mol/L的盐酸溶液中,产生的H2的体积之比(标准状态)是( )
A. 1:1:1 B. 1:2:3 C. 2:1:1 D. 6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用Na2O2与H2O反应快速制取少量O2。用如图所示装置制取O2并进行Na在O2中燃烧的实验。请回答下列问题:

(1)关闭装置中的止水夹a后,开启活塞b,漏斗中的液体不断往下滴,直至全部流入试管。试判断装置是否漏气__________(填“漏气"“不漏气”或“无法确定”),说明理由:_____________________。
(2)写出A装置中所发生反应的化学方程式_______________________________。
(3)C装置中观察到的现象是__________。
(4)D装置中盛放的试剂是__________,其作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度的是
A. AgNO3B. Na2SO4C. CuCl2D. H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物用途的说法不正确的是( )
A.氢氧化铝可作胃酸的中和剂B.明矾用作净水剂
C.铝罐可久盛食醋D.制饭勺、饭盒、高压锅等的不锈钢是合金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com