
【题目】用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度的是
A. AgNO3B. Na2SO4C. CuCl2D. H2SO4
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,aLHCl溶于1000g水中,得到的盐酸密度为bg·mL-1,则该盐酸浓度是:
A.a/22.4 mol·L-1
B.ab/22400 mol·L-1
C.ab/(22400+36.5) mol·L-1
D.1000ab/(22400+36.5a) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属粉末的混合物52g,溶于足量的稀硫酸中,生成标准状况下的氢气22.4L,则这种混合物不可能是( )
A. Na和K B. Mg和Al C. Cu和Al D. Al和Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、J是元素周期表前四周期中的五种常见元素。其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | M层上有2对成对电子 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
(2)元素Y位于元素周期表第 ______ 周期第 ______ 族;
(3)元素Z的原子最外层共有 ______ 种不同运动状态的电子;
(4)W的基态原子核外电子排布式是 ____ ,W的基态原子核外价电子排布图是 ______ ;
(5)元素Y与元素Z相比,非金属性较强的是 ______ (用元素符号表示),下列表述中能证明这一事实的是 ______ ;
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性较强的是 ______ (用化学式表示);比较下列物质的酸性强弱HZO ______ HZO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式__________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)![]() SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
3SiH2Cl2(g)![]() SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
则反应4SiHCl3(g)![]() SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
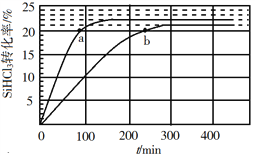
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________;要缩短反应达到平衡的时间,可采取的措施有____________、___________。
③比较a、b处反应速率大小:υa________υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]()
![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体缺乏维生素C(Vc)易得坏血症。下图是维生素C的结构简式。

请根据其结构推断性质:
(l)Vc的分子式是_________
(2)Vc分子中,除含酯基外,还有____(填官能团名称)。
(3)在维生素C溶液中滴加紫色石蕊试液,溶液颜色变红,说明维生素C具有_____性,在维生素C溶液中滴入少量蓝色的含有淀粉的碘溶液,可观察到溶液蓝色褪去,说明维生素C具有 ___性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铝的化合物的说法正确的是( )
A. 氢氧化铝能中和胃酸,可用于治疗胃酸过多
B. 工业上利用电解熔融氯化铝冶炼铝
C. 氧化铝坩埚可用于熔融NaOH实验
D. 明矾可用于自来水的消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“百炼成钢”是指反复将炽热的生铁在空气中锤打,转化为坚硬的钢,其实质是对生铁的不断除杂过程。下列叙述不正确的是( )
选项 | 被提纯物质 | 杂质 | 除杂试剂或方法 |
A | FeCl3溶液 | FeCl2 | 通入适量Cl2 |
B | FeCl2溶液 | FeCl3 | 加入过量铁粉并过滤 |
C | 铁粉 | 铝粉 | 加入过量NaOH溶液并过滤 |
D | NaHCO3溶液 | Na2CO3 | 滴加适量稀盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com