
| A、+1 | B、+2 | C、+3 | D、+6 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、c(HCO3-)<c(CO32-) |
| B、两溶液都能使酸性高锰酸钾溶液褪色 |
| C、c(HCO3-)>c(HSO3-) |
| D、c(CO32-)+c(HCO3-)═c(SO32-)+c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
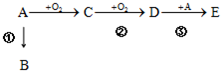
查看答案和解析>>
科目:高中化学 来源: 题型:
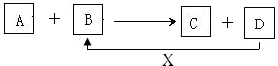
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③④⑥ |
| C、②③④⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体使湿润的酚酞试液变红 |
| B、气体能使湿润的红色石蕊试纸变蓝 |
| C、气体与蘸有浓H2SO4的玻璃棒靠近 |
| D、气体与蘸有浓盐酸的玻璃棒靠近 |
查看答案和解析>>
科目:高中化学 来源: 题型:
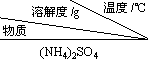 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4?FeSO4?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
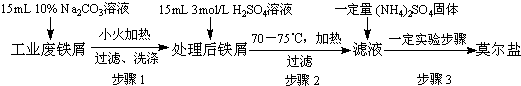

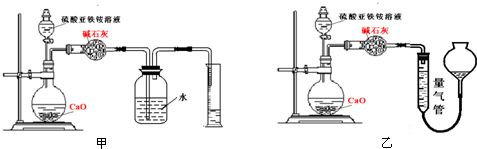
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com